
(14分)无机物A是一种固体,熔点178℃,30℃以下为浅黄色。经测定A(相对分子质量为184)含两种元素,原子个数比为1:1。隔绝空气迅速加热A将发生爆炸,爆炸后残留物B呈淡黄色。该淡黄色物质在空气中加热会燃烧并产生刺激性气味。在一定条件下,6.18g液体SCl2和2.72g气体C恰好完全反应生成A和单质B及6.42克化合物D。加热D发现无任何物质存在,把D溶于水测得溶液的pH小于7。已知气体C在标准状况下的密度为0.76g·L-1。
(1)A的化学式为 ,C的电子式 。
(2)写出SCl2和气体C反应的化学方程式 。
(3)1molSCl2能与2mol乙烯发生加成反应生成一种化学毒气芥子气,写出发生反应的化学方程式 。
(4)亚硝酸钠和D固体在加热条件下 (填“可能”或“不能”)发生反应,判断理由是 。
(5)请设计检验物质D的实验方案 。
(1)N4S4,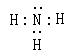 ;(2)6SCl2+16NH3= N4S4+2S+12NH4Cl;
;(2)6SCl2+16NH3= N4S4+2S+12NH4Cl;
(3)SCl2+2CH2=CH2→Cl—CH2—CH2—S—CH2—CH2—Cl ;
(4) 可能; NaNO2中的氮的化合价为+3价,NH4Cl中的氮的化合价为-3价,因而有可能发生氧化还原反应生成氮气 ;
(5)取少量D固体加水溶解,分成两份。其中一份与NaOH溶液混合加热,若产生使湿润的红色石蕊试纸变蓝的气体则证明有NH4+;另一份溶液中加入硝酸酸化的AgNO3溶液,若出现白色沉淀,则证明有Cl-离子。
解析试题分析:(1)隔绝空气迅速加热A将发生爆炸,爆炸后残留物单质B呈淡黄色。该淡黄色物质在空气中加热会燃烧并产生刺激性气味气体,则B是S单质。在标准状况下C的的密度为0.76g·L-1,则C的摩尔质量是0.76g/L×22.4L/mol=17g/mol。则C为NH3.其电子式为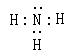 。n(SCl2)= 6.18g÷103g/mol=0.06ml;n(NH3)= 2.72g÷17g/mol=0.16mol。加热化合物D发现无任何物质存在,把D溶于水测得溶液的pH小于7。根据元素守恒可得D为NH4Cl。n(NH4Cl)= 6.42g÷53.5g/mol=0.12mol。所以在物质A中含有N:0.04mol,含有H:0.16×3-0.12×4=0mol。A含两种元素,原子个数比为1:1,因此另一种元素是S,设其化学式是(SN)n。因为相对分子质量为184,所以46n=184,因此n=4.A的化学式为N4S4。(2)因为n(NH3)= 0.16mol;n(NH4Cl)= 0.12mol。则A物质含有N原子0.04mol,所以A的物质的量为0.01mol.,产生的S单质的物质的量为0.06ml=0.04mol=0.02mol。根据生成的物质结合元素守恒可得SCl2和氨气反应的方程式为6SCl2+16NH3= N4S4+2S+12NH4Cl;(3)根据题意及物质间的物质的量关系可得方程式为SCl2+2CH2=CH2→Cl—CH2—CH2—S—CH2—CH2—Cl ;(4)由于在亚硝酸钠中N的化合价为+3价,在NH4Cl中N的化合价为-3价,所以根据氧化还原反应的规律,二者在加热条件下能够发生反应。产生中间价态的物质氮气。(5)离子的检验方法是取少量D固体加水溶解,分成两份。其中一份与NaOH溶液混合加热,若产生使湿润的红色石蕊试纸变蓝的气体则证明有NH4+;另一份溶液中加入硝酸酸化的AgNO3溶液,若出现白色沉淀,则证明有Cl-离子。
。n(SCl2)= 6.18g÷103g/mol=0.06ml;n(NH3)= 2.72g÷17g/mol=0.16mol。加热化合物D发现无任何物质存在,把D溶于水测得溶液的pH小于7。根据元素守恒可得D为NH4Cl。n(NH4Cl)= 6.42g÷53.5g/mol=0.12mol。所以在物质A中含有N:0.04mol,含有H:0.16×3-0.12×4=0mol。A含两种元素,原子个数比为1:1,因此另一种元素是S,设其化学式是(SN)n。因为相对分子质量为184,所以46n=184,因此n=4.A的化学式为N4S4。(2)因为n(NH3)= 0.16mol;n(NH4Cl)= 0.12mol。则A物质含有N原子0.04mol,所以A的物质的量为0.01mol.,产生的S单质的物质的量为0.06ml=0.04mol=0.02mol。根据生成的物质结合元素守恒可得SCl2和氨气反应的方程式为6SCl2+16NH3= N4S4+2S+12NH4Cl;(3)根据题意及物质间的物质的量关系可得方程式为SCl2+2CH2=CH2→Cl—CH2—CH2—S—CH2—CH2—Cl ;(4)由于在亚硝酸钠中N的化合价为+3价,在NH4Cl中N的化合价为-3价,所以根据氧化还原反应的规律,二者在加热条件下能够发生反应。产生中间价态的物质氮气。(5)离子的检验方法是取少量D固体加水溶解,分成两份。其中一份与NaOH溶液混合加热,若产生使湿润的红色石蕊试纸变蓝的气体则证明有NH4+;另一份溶液中加入硝酸酸化的AgNO3溶液,若出现白色沉淀,则证明有Cl-离子。
考点:考查物质的分子式、电子式和反应的方程式的书写、离子的检验、化学式的推断的知识。


科目:高中化学 来源: 题型:单选题
设NA表示阿伏加德罗常数的值,下列说法不正确的是
| A.T0C时,1 L pH=6的纯水中,含有的OH-数目为1×10-6NA |
| B.12.0 g NaHSO4固体中含有的阳离子数目为0.1 NA |
| C.50 g 98%的浓硫酸中,所含的氧原子数目为2NA |
| D.1 molNa2O2与足量CO2充分反应转移的电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室需要0.1 mol/L NaOH溶液450 mL和0.5mol/L硫酸溶液480 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液需要的是 (填字号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称)。
(2)下列操作中,是容量瓶所具备的功能有 。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.配制任意浓度和体积的标准溶液 D.稀释某一浓度的溶液 E.量取一定体积的液体
(3)根据计算用托盘天平称取NaOH的质量为 g。在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度 (填“大于”“等于”或“小于”)0.1 mol/L。若NaOH溶液在转移至容量瓶时,洒落了少许,则需要如何操作: 。
(4)根据计算得知,所需质量分数为98%、密度为l.84 g/cm3的浓硫酸的体积为 ml。如果实验室有10 mL,15 mL,20 mL量筒,应选用 mL的量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是 。
(5)下列操作会使配制的NaOH溶液浓度偏低 的是。
A.用滤纸称量NaOH B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线 D.整个配制过程中,容量瓶不振荡
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(4分)取14.3g Na2CO3?XH2O 溶于水配成100m L 溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸 20.0m L,并收集到1.12 L CO2(标准状况)。试计算:
(1)稀盐酸物质的量浓度为 mol/L;
(2)x值是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol。
(1)原NaOH溶液的质量分数为 ;
(2)所得溶液中Cl-的物质的量为 mol;
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下: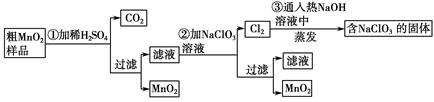
(1)第①步加稀H2SO4时,粗MnO2样品中的 (写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式是 +
+ ClO3-+
ClO3-+ =
= MnO2↓+
MnO2↓+ Cl2↑+
Cl2↑+ 。
。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、 、 、 ,已知蒸发得到的固体中有NaClO3和NaOH,则一定还含有 (写化学式)。
(4)若粗MnO2样品的质量为12.69 g,第①步反应后,经过滤得到8.7 g MnO2,并收集到0.224 L CO2(标准状况下),则在第②步反应中至少需要 mol NaClO3。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
| | 溶质的物质的量浓度/mol·L-1 | 溶液的密度/g·cm-3 |
| 硫酸 | c1 | ρ1 |
| 氨水 | c2 | ρ2 |
 c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________
c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________ c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
根据下列各题所给出的数据,可分别求出其“溶质的质量分数”或“溶质的物质的量
浓度”,试判断并求解。
(1)设NA表示阿伏加德罗常数的数值,若某氢氧化钠溶液V L中含有N个OH-,则可求出此溶液中______________________为__________________。
(2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1∶a,则可求出此溶液中________为________。
(3)已知标准状况下1体积水能溶解500体积的氯化氢,则可求出标准状况下氯化氢饱和溶液中__________为________。
(4)已知将100 mL氯化铝的水溶液加热蒸干灼烧,可得到白色固体b g,则可求出原氯化铝溶液中________为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
乙烯和乙烷的混合气体共a mol,与b mol O2共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45 g H2O,试求:
(1)当a=1时,乙烯和乙烷的物质的量之比n(C2H4)∶n(C2H6)= 。
(2)当a=1,且反应后CO和CO2的混合气体的物质的量为反应前O2的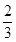 时,b= ,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)= 。
时,b= ,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)= 。
(3)a的取值范围是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com