
常温下,在pH=13的无色溶液中,可以大量共存的一组离子是
| A.Na+、SO32-、AlO2-、NO3- |
| B.CO32-、NO3-、HCO3-、Na+ |
| C.NH4+、NO3- 、K+、SO42- |
| D.MnO4-、K+、Na+、SO32- |
A
解析试题分析:离子间如果发生化学反应,则不能大量共存,反之是可以的。在pH=13的无色溶液中,溶液显碱性,所以选项A中的离子可以大量共存。B中的HCO3-、C中的NH4+均不能大量共存。D中的MnO4-在溶液中显紫红色,不能大量共存,答案选A。
考点:考查离子共存的正误判断
点评:该题是高考中的高频题,属于中等难度的试题,侧重对学生基础知识的训练和检验。有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该题需要明确离子不能大量共存的一般情况,即(1)能发生复分解反应的离子之间;(2)能生成难溶物的离子之间;(3)能发生氧化还原反应的离子之间;(4)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:单选题
下列离子方程式正确的是
| A.氨水吸收足量的SO2气体:OH-+SO2=HSO3- |
| B.稀硝酸中加入过量铁粉: Fe + 4H++ NO3-=Fe3++ NO↑ + 2H2O |
| C.用NaOH溶液吸收废气中氮氧化物:NO+NO2+OH-=NO2-+H2O |
D.苯酚钠溶液中通入少量CO2: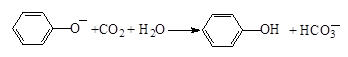 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在酸性溶液中,下列各组离子能大量共存且溶液为无色透明的是
| A.Na+、K+、OH-、Cl- | B.Na+、Cu2+、SO42-、NO3- |
| C.Mg2+、Na+、SO42-、Cl- | D.K+、Na+、NO3-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
钠与水反应的离子方程式正确的是( )
| A.2Na+3H+=2Na++H2↑ |
| B.Na+H2O=Na++OH-+H2↑ |
| C.2Na+2H2O=2Na++2OH-+H2↑ |
| D.2Na+2H2O=2Na++O2↑+2H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定能在下列溶液中共存的离子组是( )
| A.加入铝粉有气体放出的溶液中:Na+、NH4+、NO3-、Cl- |
| B.加入NaOH溶液后加热既有气体放出又有沉淀生成的溶液中:Mg2+、NH4+、SO42-、Na+ |
| C.pH=0.3的溶液中:Na+、Al3+、SO42-、CO32- |
| D.存在较多H+、SO42-、NO3-的溶液中:Al3+、CH3COO-、Cl-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列相关反应的离子方程式书写正确的是
| A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+ = Fe3++3H2O |
| B.硫酸铜溶液显酸性:Cu2+ + 2H2O = Cu(OH)2↓+ 2H+ |
C.向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-  NH3↑+H2O NH3↑+H2O |
| D.用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2 = 2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列离子方程式书写正确的是
| A.硫氢化钠的水解:HS-+H2O === S2-+H3O+ |
| B.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=== Fe3++3H2O |
| C.钢铁发生吸氧腐蚀的负极反应式:O2+4e-+2H2O === 4OH- |
| D.碳酸氢铵溶液中滴入少量烧碱溶液:HCO3-+OH-=== CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)完成下列反应的离子方程式:
(1)向NaHSO4溶液中逐滴加入Ba(OH)2溶液,使原溶液中的SO42—恰好完全沉淀:
(2)向明矾溶液中逐滴加入Ba(OH)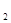 溶液,当Al3+恰好全部沉淀时:
溶液,当Al3+恰好全部沉淀时:
(3)向Ca(HCO3) 2溶液中加入过量的NaOH溶液:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度, 若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2气体的吸收率。具体情况如图所示。请回答下列问题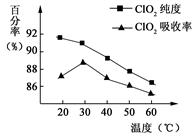
(1)据图可知,反应时需要控制的适宜温度是 ℃,达到此要求采取的适宜措施是 。
(2)已知:黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备二氧化氯的离子方程式: 。
(3)某校化学学习小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品质量6.0g,通过反应和吸收可得400 mL ClO2溶液,取出20 mL,加入37.00 mL 0.500mol·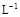 (NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·
(NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·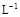 K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
4H++ClO2+5Fe2+=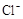 +5Fe3+ +2H2O 14H+ +
+5Fe3+ +2H2O 14H+ +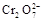 +6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
+6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
试计算ClO2的“产率”。(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com