
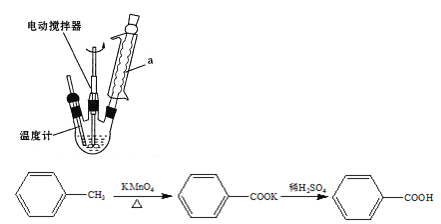
����Ŀ����������һ����Ҫ�Ļ���ԭ�ϡ�ʵ���Һϳɱ������ԭ����װ��ʾ��ͼ(���ȡ� �гּ���������ʡ��)��һЩ�����Ϣ���£�
���� | ��״ | �۵㣨�棩 | �е㣨�棩 | �ܶȣ�g/mL�� | �ܽ��� | |
ˮ | �Ҵ� | |||||
�ױ� | ��ɫҺ����ȼ�ӷ� | ��95 | 110.6 | 0.8669 | ���� | ���� |
������ | ��ɫƬ״����״���� | 112.4��100������������ | 248 | 1.2659 | �� | ���� |
��������ˮ�е��ܽ�������
�¶�/�� | 4 | 18 | 75 |
�ܽ��/g | 0.2 | 0.3 | 2.2 |
ijѧϰС����ʵ�����Ʊ������롢�ᴿ�����ᣬ���ⶨ������Ʒ�Ĵ��ȣ��������£�
��.��b �м��� 2.7 mL �ױ���100 mLˮ�ͼ�Ƭ���Ƭ�������綯��������a��ͨˮ����b �е�Һ����������ڣ��������� 8.5 g ������أ���������Լ5 h��ֹͣ���Ⱥͽ��裬���á�
��.�ڷ�Ӧ������м���һ��������(H2C2O4)��ַ�Ӧ�����ˡ�ϴ�ӣ�����Һ���ڱ�ˮԡ����ȴ������Ũ�����ữ��������ȫ���������ѹ���ˣ���ˮϴ�ӣ�����õ��ֲ�Ʒ��
��.��ȡm g��Ʒ����� 100 mL�Ҵ���Һ����ȡ25.00 mL��Һ����ƿ���μ�2��3�η�̪��Ȼ���ñ�Ũ��KOH��Һ�ζ�����ش��������⣺
(1)װ��a������___________
(2)�����ᴿ�����м���IJ�����һ�ֶ�Ԫ���ᣬ��Ӧ����������ʽ�κ���ɫ�������ɡ�������������_______���������ӷ�ʽ��ʾ�÷�Ӧԭ��_____��
(3)��Ʒ��ѹ����ʱ����ˮϴ�ӵ�ԭ����_____________
(4)ѡ������________(ѡ����ĸ)���������Խ��ֲ�Ʒ��һ���ᴿ��
A ����ˮ����� B �����Ҵ�������
C �üױ���ȡ���Һ D ����
(5)�ⶨ���Ȳ����У��ζ��յ���Һ����ɫ�仯��__����m��1.200 g���ζ�ʱ��ȥ0.1200 mol��L��1 ��KOH��Һ20.00 mL�������ò�Ʒ�б��������������Ϊ______��
���𰸡������������ֹ�ױ��Ļӷ������Ͳ�Ʒ���� �������ĸ������ת��Ϊ�������̣��Ա���˳�ȥ 3H2C2O4 +2MnO4-= 2HCO3-+2MnO2��+2H2O+4CO2�� ����������ˮ�е��ܽ�Ƚ�С������ˮϴ�ӿ��Լ��ٲ�Ʒ����ʧ D ��Һ����ɫ��Ϊdz��ɫ���Ұ���Ӳ���ɫ 97.6%
��������
��1������������ȼ�ӷ���Һ�壬װ��b�мױ�Һ�����������ʱ�ױ��ӷ������������ʣ����������������ܽ��ױ�����������������ֹ�ױ��Ļӷ������Ͳ�Ʒ���ʣ�
��2��H2C2O4���л�ԭ�ԣ��ɽ�������KMnO4��ԭΪMnO2�����˳�ȥ��H2C2O4��KMnO4����ΪKHCO3��CO2������������ԭ��Ӧ��ԭ���ɵ÷�Ӧ���������ʽΪ3H2C2O4 +2MnO4-= 2HCO3-+2MnO2��+2H2O+4CO2����
��3���ɱ��б�������ˮ�е��ܽ�ȱ���֪������������ˮ�е��ܽ�Ƚ�С���������ᾧ������ˮϴ�ӿ��Լ��ٲ�Ʒ����ʧ��
��4���ɱ��б���������ʿ�֪����������100������������KCl���۷е�ܸߣ��������������ᴿ�����Ȼ��صı�������Բ��������ķ����õ��ϴ��ı����ᣬ
�ʴ�Ϊ��D��
��5��������Ҵ���Һ�еμӷ�̪����Һ��ɫ���ñ�Ũ��KOH��Һ�ζ�������Һ��dz��ɫ�Ұ��������ɫ����ɫʱ��˵���ﵽ�ζ��յ㡣�ﵽ�ζ��յ�ʱ��25.00mL��Ʒ��Һ�У�n��KOH��=cV=0.02L��0.12molL��1 =0.0024mol�����������������ص����ʵ���ǡ�÷�Ӧ����n�������ᣩ=0.0024mol������������Ϊ0.0024mol��122g/mol��![]() =1.1712g�����Բ�Ʒ�б�������������Ϊ
=1.1712g�����Բ�Ʒ�б�������������Ϊ![]() ��100%=97.6%��
��100%=97.6%��


 ��ѧȫ��������ѵ��ϵ�д�
��ѧȫ��������ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2016���ҹ�������Ա���Ƴ�һ�����¡��ɺ�����NaCO2��ء��ŵ�ʱ�õ�ء����롱CO2�����ʱ��������CO2������CO2ʱ���乤��ԭ������ͼ��ʾ�����յ�ȫ��CO2�У���2/3ת��ΪNa2CO3��������ڶ��̼���ܣ�MWCNT���缫���档����˵����ȷ���ǣ�

A�������롱CO2ʱ���Ʋ�Ϊ����
B����������CO2ʱ��Na+����̼���ܵ缫�ƶ�
C�������롱CO2ʱ��������Ӧ��4Na+ + 3CO2 + 4e��= 2Na2CO3 + C
D����״���£�ÿ��������22.4LCO2��ת�Ƶ�����Ϊ0.75mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ô��м����ⶨ��Ȫʵ���е�ѹǿ�仯����ʶ��Ȫʵ���ԭ��������˵����ȷ����

A. ��ȡ����ʱ��ƿ�еĹ��峣��CaO��CaCl2
B. ��ʪ�����ɫʯ����ֽ��������ƿ�ڣ���ֽ��죬˵��NH3�Ѿ�����
C. �ر�a����������(��������ˮ�Ľ�ͷ�ι�)��������c����b�������Ȫʵ�飬���Ի�������ƿ��ѹǿ�仯������ͼ2����E��ʱ��Ȫ�����
D. ��ҵ�ϣ�������Һ��й©����ϡ���������NaHCO3��Һ����Ч����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ӻ�Br-�ķ�Һ����ȡ�嵥�ʣ��辭��һϵ�в�����ʵ��װ�ü����ʵ�����������

Br2 | CCl4 | ��ʮ���� | |
�ܶ�/g��cm-3 | 3. 12 | 1.59 | 0.753 |
�е�/�� | 58.76 | 76.8 | 215��217 |
����˵������ȷ����
A. ����װ�ü�������Һ�е�Br-
B. װ������ѡ����ʮ���������CCl4������Ϊ��ʮ������ܶȸ�С
C. ��װ�ñ������������ռ���ʮ�������ռ�Br2
D. ��װ�ö���������Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
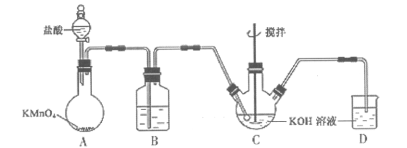
����Ŀ��ij��ѧ�о���ѧϰС��Ϊ�˽�ӹ�ҵ�����ᴿ��ķ������������й����ϣ�Br2�ķе�Ϊ59�棬����ˮ���ж��Ժ�ǿ��ʴ�ԡ����Dzι��������̺�������װ�ü�ͼ��

�������������ۣ�
��1��ͼ������B�����ƣ�____________________��
��2������ʵ��װ�����������Ӿ��������������ܣ���ԭ����_____________��
��3��ʵ��װ�����������ã�Ҫ�ﵽ�ᴿ���Ŀ�ģ���������ο��ƹؼ�������_________________________________________________��
��4��C��Һ�������ɫΪ___________________��Ϊ��ȥ�ò������Բ���������Cl2���������м���NaBr��Һ����ַ�Ӧ���ٽ��з���IJ�����_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fritz Haber�ںϳɰ�����Ĺ�����Ѿ�110���꣬����Ԫ�ؼ��仯����Ӧ�ù㷺��
(1)�ڻ�̬13Nԭ���У��������__________�������෴�ĵ��ӣ��������ռ�ݵ�����ܼ��ĵ���������ͼΪ__________�Ρ�
(2)���ݼ۲���ӶԻ������ۣ�NH3��NO3-��NO2-�У�����ԭ�Ӽ۲���Ӷ�����ͬ�������������ӵ���________����NO3-��Ϊ�ȵ�����ķ���Ϊ__________��Һ���д��ڵ���ƽ��2NH3![]() NH4+��NH2-�����ݼ۲���ӶԻ������ۣ�����֪NH2-�Ŀռ乹��Ϊ__________��Һ����ϵ�ڣ���ԭ�ӵ��ӻ��������Ϊ________��NH3��PH3������Һ����ԭ��Ϊ__________________��
NH4+��NH2-�����ݼ۲���ӶԻ������ۣ�����֪NH2-�Ŀռ乹��Ϊ__________��Һ����ϵ�ڣ���ԭ�ӵ��ӻ��������Ϊ________��NH3��PH3������Һ����ԭ��Ϊ__________________��
(3)�ҹ���ѧ������ʵ�������״�ȫ��������(N5-)������Co(N5)2(H2O)4��4H2O�ĺϳɣ���ṹ��ͼ��ʾ����֪N5-�Ļ�ѧ��������______________��

(4)���ض����ʵ���֮�ȵ�NH4Cl��HgCl2���ܷ����һ�����ʱ�����ɾ���X���侧���Ľṹͼ������������ͼ��ʾ������X�Ļ�ѧʽΪ__________���侧���ܶ�Ϊ__________(�谢���ӵ�������ֵΪNA���г�����ʽ)g��cm��3��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������ﵽԤ��ʵ��Ŀ�ĵ���
��� | ʵ������ | ʵ��Ŀ�� |
A�� | ��2.5g CuSO4��5H2O�ܽ���97.5g ˮ�� | ������������Ϊ1.6%��CuSO4��Һ |
B�� | �����£���pH��ֽ�ⶨŨ��Ϊ0.1mol��L��1NaClO��Һ��0.1mol��L��1CH3COONa��Һ��pH | �Ƚ�HClO��CH3COOH������ǿ�� |
C�� | ��ʢ��1mL��������Һ���Թ��еμ�NaCl��Һ���������г������ɣ��������еμ�Na2S��Һ | ˵��һ�ֳ�����ת��Ϊ��һ�ָ����ܵij��� |
D�� | �ֱ���2֧�Թ��м���5mL4����5mL12���Ĺ���������Һ���ٸ����뼸��0.2mol��L��1FeCl3��Һ | �о�Ũ�ȶԷ�Ӧ���ʵ�Ӱ�� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ijѧУʵ���Ҵӻ�ѧ�Լ��̵���ص������Լ���ǩ�ϵIJ������ݡ��ݴ�����˵����ȷ����(����)

A. ����������ʵ���Ũ��Ϊ9.2 mol��L��1
B. 1 mol Zn�����������ᷴӦ����2 g����
C. ����200 mL 4.6 mol��L��1��ϡ������ȡ������50 mL
D. ���������������ˮ��Ϻ�������Һ��Ũ�ȴ���9.2 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������(K2FeO4)��һ�����ͣ���Ч�������ɫˮ����������ͨ��KClO��Һ��Fe(NO3)3��Һ�ķ�Ӧ�Ʊ���
��֪����KClO�ڽϸ��¶��·����绯��Ӧ����KClO3
��K2FeO4�����������ʣ�������ˮ������ŨKOH��Һ����ǿ������Һ�бȽ��ȶ�����Fe3+�������·����ֽ⣬�������������������£�����ˮ��Ӧ����Fe(OH)3��O2����ͼ��ʾ��ʵ����ģ�ҵ�Ʊ�KClO��Һװ�á�
(1)Bװ�õ�����Ϊ______________________��
(2)��Ӧʱ�轫Cװ��������ˮԡ�У���ԭ��Ϊ__________________��
(3)�Ʊ�K2FeO4ʱ�����ܽ����Ե�KClO��Һ�μӵ�Fe(NO3)3������Һ�У���ԭ����________���Ʊ�K2FeO4�����ӷ���ʽ_________________��
(4)��ҵ�ϳ��÷���мΪԭ���Ʊ�Fe(NO3)3��Һ����Һ�п��ܺ���Fe2+������Fe2+�����Լ�����________���䷴Ӧԭ��Ϊ______________________(�����ӷ���ʽ��ʾ)��
(5)��Ӧ�������ƿ�м��뱥��KOH��Һ������K2FeO4���壬���ˡ�ϴ�ӡ����ϴ�Ӳ�����������Լ�Ϊ______________________��
A.ˮ B.��ˮ�Ҵ� C.ϡKOH��Һ
(6)��ҵ��������ӵ��������ⶨ������صĴ��ȣ��ü���KI��Һ�ܽ�1.00g K2FeO4��Ʒ������pHʹ�������ȫ������ԭ���������ӣ��ٵ���pHΪ3��4����1.0mol/L��Na2S2O3����Һ��Ϊ�ζ������еζ�(2Na2S2O3+I2=Na2S4O6+2NaI)��������ָʾ����װ��Na2S2O3����Һ�ĵζ�����ʼ���յ��������ͼ��ʾ��
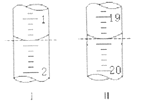
������Na2S2O3����Һ�����Ϊ____________mL��
��ԭ��Ʒ�и�����ص���������Ϊ_________________��[M(K2FeO4)=198g/mol]
����������Na2S2O3����Һ�Ĺ����ж���ʱ���ӿ̶��ߣ��������������ص���������____________(����ƫ��������ƫ����������Ӱ����)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com