
下列说法正确的是
A.NH3的水溶液能导电,所以NH3是电解质
B.BaSO4其水溶液几乎不导电,但BaSO4是电解质
C.液溴不导电,所以液溴是非电解质
D.食盐水能导电,故其属于电解质
科目:高中化学 来源:2015-2016学年福建省宁德市高二上期中(理)化学试卷(解析版) 题型:选择题
如果一个反应△H-T△S值为零,则此反应
A.能自发进行 B.是放热反应 C.处于平衡状态 D.不能自发进行
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省华士、成化、山观三校高二上期中选修化学试卷(解析版) 题型:选择题
过氧乙酸(CH3COOOH)是一种高效消毒剂,具有很强的氧化性和腐蚀性,可以迅速杀灭多种微生物,包括多种病毒(如SARS病毒)、细菌、真菌及芽孢.过氧乙酸可由冰醋酸与过氧化氢在一定条件下作用制得,下列有关过氧乙酸的叙述中正确的是
A. 过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体
B. 过氧乙酸与苯酚混合使用,可增强过氧乙酸杀菌效果
C.由下列过氧乙酸的制取原理可以看出,过氧乙酸是酯的同系物
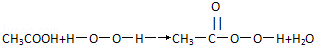
D. 浓过氧乙酸溶液中加入少许紫色石蕊试液,振荡后,先变红后褪色
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西八一、洪都、麻丘中学等高一上期中联考化学试卷(解析版) 题型:选择题
下列变化过程中,需要加入氧化剂的是
A.HCl H2 B.HCl
H2 B.HCl FeCl2
FeCl2
C.Fe Fe2O3 D.H2SO4(浓)
Fe2O3 D.H2SO4(浓) SO2
SO2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏银川第九中学高二上学期期中测试化学试卷(解析版) 题型:选择题
下列说法或表示正确的是
A. 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B. 物质发生化学变化时一定伴随着放热现象
C. 稀溶液中:H+(aq)+OH﹣(aq)=H2O(l);△H=﹣57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含l mol NaOH的溶液混合,放出的热量大于57.3kJ
D. 在25℃101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ的热量,则H2燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l);△H=﹣285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期期中阶段测试化学试卷(解析版) 题型:选择题
在一密闭容器中有HCHO、H2、O2共26.5 g,用电火花引燃烧,使其完全燃烧,再将燃烧后的气体用Na2O2充分吸收,Na2O2 增重10.5 g,则原混合气体中O2的物质的量是
A.0.5 mol B.0.25 mol C.0.27 mol D.0.52 mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省宣城、郎溪、广德三校高二上期中联考化学试卷(解析版) 题型:填空题
下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
(1)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看成酸,则酸性最强的是 ,最弱的是 。
(2)多元弱酸的二级电离程度远小于一级电离的原因是 。
(3)同浓度的CH3COO-、HCO3—、CO32—、S2-结合H+的能力由强到弱的顺序为 。
(4)在温度相同时,各弱酸的K值不同,K值越大酸越 (填“强”或 “弱”)。
(5)根据K值大小判断下列反应能否发生:CH3COOH + H2PO4- (填“能”或“不能”,下同) H2CO3 + HS-
(填“能”或“不能”,下同) H2CO3 + HS- 。
。

查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高二上学期期中测试化学试卷(解析版) 题型:填空题
根据已学知识,请你回答下列问题:
(1)元素的原子最外层电子排布式为nsnnpn+1,该元素的名称为______________;
(2)C、N、O、F电负性由大到小的顺序是 ;
(3)铜基态核外电子排布式是________ _;
(4)钛的基态M能层电子排布图 ;
(5)C、N、O、F第一电离能由大到小的顺序是 ;
(6)铬元素在周期表中位于__________区;
(7)一至四周期中,未成对电子数和能层数相等的元素有 种;
(8)仅由第二周期元素组成的共价分子中,互为等电子体的是CO2和_________;N2和________。
(9)CH2=CH2中碳原子采取 杂化;
(10)水分子的空间构型为 。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省盐城市高三上学期期中测试化学试卷(解析版) 题型:实验题
焦亚硫酸钠(Na2S2O5)在食品加工中常用作防腐剂、漂白剂和疏松剂。焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化。实验室制备焦亚硫酸钠过程中依次包含以下几步反应:
2NaOH + SO2 = Na2SO3 + H2O……(a)
Na2SO3+ H2O + SO2 = 2NaHSO3 ……(b)
2NaHSO3 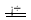 Na2S2O5 + H2O……(c)
Na2S2O5 + H2O……(c)
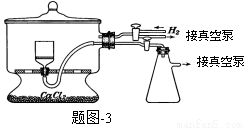
实验装置如下:

(1)实验室可用废铝丝与NaOH溶液反应制取H2,制取H2的离子方程式为 。
(2)题图-1装置中,导管X的作用是 。
(3)通氢气一段时间后,以恒定速率通入SO2,开始的一段时间溶液温度迅速升高,随后温度缓 慢变化,溶液开始逐渐变黄。“温度迅速升高”的原因为 ;
慢变化,溶液开始逐渐变黄。“温度迅速升高”的原因为 ;
实验后期须保持温度在约80℃,可采用的加热方式为 。
(4)反应后的体系中有少量白色亚硫酸钠析出,参照题图-2溶解度曲线,除去其中亚硫酸钠固体的方法是 ;然后获得较纯的无水Na2S2O5应将溶液冷却到30℃左右抽滤,控制“30℃左右”的理由是 。
(5)用题图-3装置干燥Na2S2O5晶体时,通入H2的目的是 ;真空干燥的优点是 。
(6)测定产品中焦亚硫酸钠的质量分数常用剩余碘量法。已知:S2O52-+2I2+3H2O=2SO42-+4I-+6H+;2S2O32-+I2 = S4O62-+2I-
请补充实验步骤(可提供的试剂有:焦亚硫酸钠样品、标准碘溶液、淀粉溶液、酚酞溶液、标准Na2S2O3溶液及蒸馏水)。
①精确称取产品0.2000g放入碘量瓶(带磨口塞的锥形瓶)中。
②准确移取一定体积和已知浓度的标准碘溶液(过量)并记录数据,在暗处放置5min,然后加入5mL冰醋酸及适量的蒸馏水。
③用标准Na2S2O3溶液滴定至接近终点。④ 。 ⑤ 。
⑥重复步骤①~⑤;根据相关记录数据计算出平均值。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com