
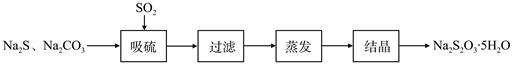
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,___________________。 | _______________ | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,___________________。 | _______________ | 样品含NaOH |
| 序号 | 实验操作 | 预期现象 |
| ① | 滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡。 | 有白色沉淀生成 |
| ② | 加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH | 有白色沉淀生成,上层清液pH大于10.2 |
| 序号 | 实验操作 | 预期现象 |
| ① | 滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡。 | 有白色沉淀生成 |
| ② | 加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH | 有白色沉淀生成,上层清液pH大于10.2 |
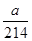 mol,则根据反应式IO3-+5I-+6H+=3I2+3H2O、2S2O32-+I2=S4O62-+2I-可知:IO3-~~~~~6S2O32-
mol,则根据反应式IO3-+5I-+6H+=3I2+3H2O、2S2O32-+I2=S4O62-+2I-可知:IO3-~~~~~6S2O32-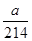 mol
mol 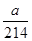 mol×6
mol×6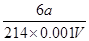 mol/L=
mol/L=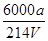 mol/L
mol/L

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源:不详 题型:实验题
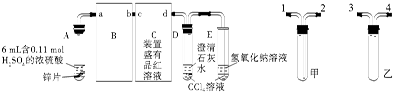
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
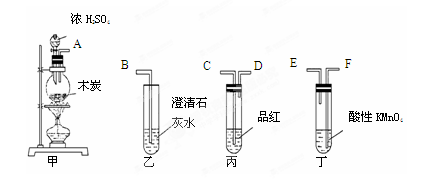
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2通入品红溶液,溶液褪色的原理与SO2通入溴水后褪色的原理相同 |
| B.浓硫酸具有强氧化性,稀硫酸不具有氧化性 |
| C.用浓FeCl3溶液和NaOH溶液混合制备Fe(OH)3胶体 |
| D.明矾和漂白粉常用于自来水的净化和杀菌消毒,但二者的作用原理不同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.测pH值 | B.测导电性大小 | C.测密度 | D.进行中和滴定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2和Cl2都能使品红溶液褪色,且加热后均恢复原色 |
| B.SiO2是酸性氧化物,能与NaOH溶液反应 |
| C.紫色石蕊试液滴入SO2水溶液中,先变红后褪色 |
D.向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,则该溶液中一定含有 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2、H2S | B.SO2、NO2 | C.NH3、CO2 | D.CO2、SO2 |
查看答案和解析>>
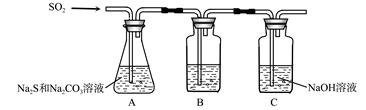
科目:高中化学 来源:不详 题型:实验题
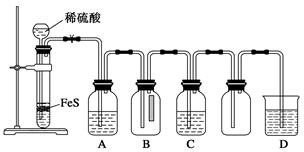
| | 实验操作 | 实验现象 |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2∶1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
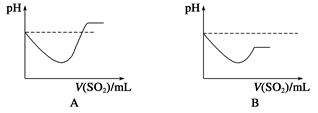
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com