
下列化合物中,含有非极性共价键的离子化合物是
A.CaC2 B.N2H4
C.Na2S2 D.NH4NO3
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是________,写出一种工业制备单质F的离子方程式:__________________________。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为__________,其水溶液与F单质反应的化学方程式为____________________________________________;在产物中加入少量KI,反应后加入CCl4并振荡,有机层显______色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1∶1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
a的化学式为________;b的化学式为______________;c的电子式为________;d的晶体类型是________。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过________键构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
重水(D2O)是重要的核工业原料,下列说法错误的是( )
A.氘(D)原子核外有1个电子 B.1H与D互称同位素
C.H2O与D2O互称同素异形体 D.1H218O与D216O的相对分子质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将0.1 mol·L-1盐酸溶液与0.06 mol·L-1氢氧化钡溶液等体积混合,该混合溶液的pH等于( )
A.1.7 B.2.0 C.12.0 D.12.4
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。请回答下列问题:
(1)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+49.0kJ/mol
②CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H=-192.9kJ/mol
由上述方程式可知,CH3OH(g)的燃烧热____(填“大于”、“等于”或小于”)192.9kJ/mol。已知水的气化热为44 kJ/mol,则表示氢气燃烧热的热化学方程式为______________________________。
(2)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考查温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃)
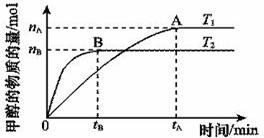
该反应为_________反应(填“放热”或“吸热”);在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能。
(1)写出基态Mn原子的核外电子排布式______________________________________。
(2)CoTiO3晶体结构模型如图1所示。在CoTiO3晶体中1个Ti原子、1个Co原子,周围距离最近的O原子数目分别为________个、________个。
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。O2在其催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO-互为等电子体的分子、离子化学式分别为________、________(各写一种)。
(4)三聚氰胺是一种含氮化合物,其结构简式如图2所示。
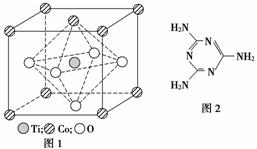
三聚氰胺分子中氮原子轨道杂化类型是________,1 mol三聚氰胺分子中σ键的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)
ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)
ΔH2=-1 160 kJ·mol-1
若在标准状况下用CH4还原4.48 L NO2气体至N2,则下列说法中正确的是
A.该过程吸收的热量为86.7 kJ
B.此过程中需要CH4气体1.12 L
C.转移的电子数为0.8NA个
D.已知2NO(g)+O2(g)===2NO2(g) ΔH=-114 kJ·mol-1,则CH4的燃烧热是802 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
| 化学方程式 | 焓变ΔH (kJ·mol-1) | |
| 甲烷 氧化 | CH4(g)+2O2(g)===CO2(g)+2H2O(g) | ΔH1 |
| CH4(g)+O2(g)===CO2(g)+2H2(g) | -322.0 | |
| 蒸汽 重整 | CH4(g)+H2O(g)===CO(g)+3H2(g) | 206.2 |
| CH4(g)+2H2O(g)===CO2(g)+4H2(g) | 165.0 |
①反应CO(g)+H2O(g)===CO2(g)+H2(g)的ΔH=________ kJ·mol-1。
②甲烷的燃烧热为ΔH2,则ΔH2________ΔH1(填“>”、“=”或“<”)。
(2)物质(tBuNO)2在正庚烷溶剂中发生如下反应:
(tBuNO)22(tBuNO) ΔH。
实验测得该反应的ΔH=+50.5 kJ·mol-1,活化能Ea=90.4 kJ·mol-1。下列能量关系图合理的是________________________________________________________________________。
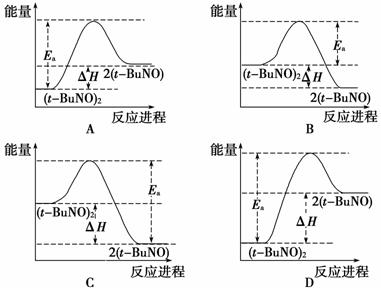
查看答案和解析>>
科目:高中化学 来源: 题型:
尼泊金甲酯是苯的含氧衍生物,在化妆品中可作防腐剂。回答下列问题:
(1)尼泊金甲酯的结构简式为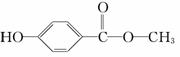 ,写出尼泊金甲酯与NaOH溶液反应的化学方程式(有机物写结构简式):_______________________
,写出尼泊金甲酯与NaOH溶液反应的化学方程式(有机物写结构简式):_______________________
___________________________________________________________________ _____。
_____。
(2)尼泊金甲酯的一种同分异构体A,满足以下条件:①含有苯环,②含有碳碳双键,③苯环上一氯取代物只有一种。写出A的可能的结构简式:____________________。
(3)尼泊金甲酯的另一种同分异构体B,其苯环上的取代基彼此相间,有如下转化关系:
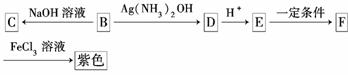
已知C的化学式为C8H7O3Na,F的化学式为C8H6O3。
填写下列空白:
①B中的官能团名称是________________,E→F的反应类型为________;
②F的结构简式为____________________;
③写出E与乙醇反应的化学方程式(有机物写结构简式,并注明反应条件):________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com