
【题目】下列关于溶液和胶体的叙述正确的是( )
A. 溶液呈电中性,而胶体是带电的,因而胶体可以产生电泳现象
B. 通电时,溶液溶质粒子移向两极,而胶体分散质移向同一极
C. 纳米碳的直径在1nm-100nm之间,因此其属于胶体
D. 三角洲的形成、夜晚霓虹灯、明矾净水及土壤保肥等均与胶体的性质有关
科目:高中化学 来源: 题型:
【题目】下列有关反应热的叙述中正确的是( )
①已知2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJmol﹣1 , 则氢气的燃烧热为△H=﹣241.8kJmol﹣1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)═Z(g)+W(s)△H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
④已知:
共价键 | C﹣C | C═C | C﹣H | H﹣H |
键能/(kJmol﹣1) | 348 | 610 | 413 | 436 |
上表数据可以计算出 ![]() (g)+3H2(g)→
(g)+3H2(g)→ ![]() (g)的反应热;
(g)的反应热;
⑤由盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1molCO2固体时,放出的热量相等;
⑥25℃,101kPa时,1mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热.
A.①②③④
B.③④⑤
C.④⑤
D.⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的分类组合正确的是( )
分类组合 | 酸 | 碱 | 盐 | 非金属氧化物 | 金属氧化物 |
A. | C2H5OH | Ca(OH)2 | K2CO3 | CO2 | CaO |
B. | HNO3 | NaHCO3 | Na2SO4 | CuO | MgO |
C. | NH3 | Ba(OH)2 | MgCl2 | P2O5 | CaO |
D. | CH3COOH | NaOH | CaCO3 | SO2 | Mn2O7 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:
①2Fe2O3(s)+3C(s)4Fe(s)+3CO2(g)△H=+460.5KJmol﹣1
②Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)△H=﹣28.5KJmol﹣1
③断裂1mol CO(s)气体中的化学键需要吸收1076KJ的能量
断裂1mol CO2(s)气体中的化学键需要吸收1490KJ的能量
请回答:
(1)断裂1mol C(s)中所有化学键需要吸收的能量为 .
(2)T1℃时,向密闭容器中加入一定量的Fe2O3和C,发生反应①,达到平衡后,CO2的浓度为a molL﹣1;其他条件不变,缩小容器容积,再次达到平衡时,CO2的浓度为b molL﹣1 , 则a(选填“>”“<”或“=”)b.
(3)起始温度均为T2℃时,向容积为10L的三个恒容密闭容器中,分别加入一定量的Fe2O3和CO发生反应②,测得相关数据如表所示:
编号 | 容器 | 起始时物质的量 mol | 平衡时物质的量/mol | 平衡常数(K) | |
Fe2O3 | CO | Fe | |||
1 | 恒温 | 0.5 | 1.5 | 0.8 | K1 |
2 | 恒温 | 2 | 3 | m | K2 |
3 | 绝热 | 1 | 1.5 | n | K3 |
①T2℃时,容器1中反应的平衡常数K1= .
②容器2中,5min达到平衡,则0~5min内以CO2表示该反应的速率v(CO2)= .
③对于三个容器中的反应,下列说法正确的是(填选项字母).
A.m>2n
B.容器1和容器2中CO的平衡转化率v1<v2 .
C.K1=K3
D.平衡时气体压强:P3>P1
(4)T2℃时,向恒压密闭容器中充入0.5mol Fe2O3和1.0mol CO,发生反应②,CO和CO2的物质的量浓度(c)与时间(t)的关系如图1所示. 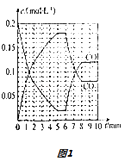
①6min时,改变的外界条件未 , 理由为 .
②10min时,再向容器中加入1 mol Fe2O3、1 mol CO、1 mol Fe、1 mol CO2、起始的反应速率v(正)(选填“>”“<”或“=”)v(逆).
(5)CO﹣O2熔融盐燃料电池的装置如图2所示,电池工作时,C口产生的气体一部分通入B口被利用,另一部分被分离出来,若导线中流过2mole﹣ , 理论上C口被分离出的气体的物质的量最多为 . 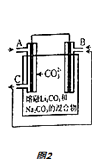
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水处理技术在生产、生活中应用广泛,对海水、工业废水和生活污水进行处理是获得淡水,防止水土污染,改善水质的主要措施.
(1)海水淡化常用的三种方法为 .
(2)具有永久硬度的水在软化时可采取的方法有(填选项字母,下同).
a.加热法b.药剂法c.离子交换法
(3)用石灰纯碱法软化硬水时,加入石灰的作用是 .
a.只能降低水中的永久硬度
b.能同时降低水中的永久硬度和暂时硬度
c.可把部分Ca2+所形成的硬度转变为Mg2+形成的硬度
d.可把部分Mg2+所形成的硬度转变为Ca2+形成的硬度
(4)生活用水必须保证安全,自来水厂需要对取自江河湖泊中的淡水进行①杀菌消毒、②混凝沉淀、③过滤等工艺处理,这三项处理的正确顺序是 . (填序号)
(5)高铁酸钠(Na2Fe04)是一种新型饮用水消毒剂,某研究小组的同学设计了用工业废铁屑(含铜、碳、硅等)制取高铁酸钠的工艺流程如图所示: 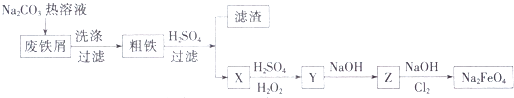
①废铁屑中加入碳酸钠热溶液的目的为 .
②滤渣的成分为(填化学式).
③写出Cl2将Z氧化为Na2FO4的化学方程式: .
④高铁酸钠消毒后的还原产物具有净水作用,解释其净水原理: .
⑤工业上还可用电化学法制备高铁酸钠:采用铁片作阳极,浓NaOH溶液作为电解质溶液.阳极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5 , 反应PCl5(g)PCl3(g)+Cl2(g)经一段时间后达到平衡.反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在前50s的平均速率为v(PCl3)=0.0032molL﹣1s﹣1
B.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11molL﹣1 , 则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20mol Cl2 , 达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3、2.0mol Cl2 , 达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课题式研究性学习是培养学生创造性思维的良好方法,某研究性学习小组将下列装置如图链接,C、D、E、F、X、Y都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附件先显红色.试回答下列问题: 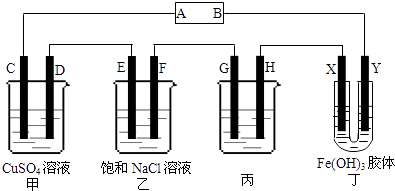
(1)电源A极的名称是
(2)甲装置中电解反应的总化学方程式:
(3)如果收集乙装置中产生的气体,相同状况下两种气体的体积比是 .
(4)欲用丙装置给铜镀银,G应该是(填“铜”或“银”),电镀液的溶质是(填化学式).
(5)装置丁中的现象是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com