
【题目】水处理技术在生产、生活中应用广泛,对海水、工业废水和生活污水进行处理是获得淡水,防止水土污染,改善水质的主要措施.
(1)海水淡化常用的三种方法为 .
(2)具有永久硬度的水在软化时可采取的方法有(填选项字母,下同).
a.加热法b.药剂法c.离子交换法
(3)用石灰纯碱法软化硬水时,加入石灰的作用是 .
a.只能降低水中的永久硬度
b.能同时降低水中的永久硬度和暂时硬度
c.可把部分Ca2+所形成的硬度转变为Mg2+形成的硬度
d.可把部分Mg2+所形成的硬度转变为Ca2+形成的硬度
(4)生活用水必须保证安全,自来水厂需要对取自江河湖泊中的淡水进行①杀菌消毒、②混凝沉淀、③过滤等工艺处理,这三项处理的正确顺序是 . (填序号)
(5)高铁酸钠(Na2Fe04)是一种新型饮用水消毒剂,某研究小组的同学设计了用工业废铁屑(含铜、碳、硅等)制取高铁酸钠的工艺流程如图所示: 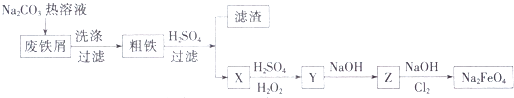
①废铁屑中加入碳酸钠热溶液的目的为 .
②滤渣的成分为(填化学式).
③写出Cl2将Z氧化为Na2FO4的化学方程式: .
④高铁酸钠消毒后的还原产物具有净水作用,解释其净水原理: .
⑤工业上还可用电化学法制备高铁酸钠:采用铁片作阳极,浓NaOH溶液作为电解质溶液.阳极的电极反应式为 .
【答案】
(1)冻结法海水淡化、蒸馏法海水淡化、反渗透海水淡化
(2)bc
(3)d
(4)②③①
(5)清洗废铁屑表面的油污;Cu、Si;10NaOH+3Cl2+2Fe(OH)3═2Na2FeO4+6NaCl+8H2O;高铁酸盐在杀菌消毒时,本身被还原成Fe3+ , Fe3+易水解生成Fe(OH)3 , 具有胶体的性质,可吸附水中的悬浮杂质,而起到净化水的作用;Fe+8OH﹣﹣6e﹣═FeO42﹣+4H2O
【解析】解:(1)冻结法海水淡化,只有淡水才能结冰,海水的含盐量比较低,冻结后含有盐分的水就排除在外了,把冰取出就是淡水了.蒸馏法海水淡化,使海水受热汽化,再使蒸汽冷凝,从而得到淡水的方法.
反渗透海水淡化,是在高于溶液渗透压的作用下,依据其他物质不能透过半透膜而将这些物质和水分离开来,
所以答案是:冻结法海水淡化、蒸馏法海水淡化、反渗透海水淡化;(2)当硬水中钙和镁主要以碳酸氢盐,如Ca(HCO3)2、Mg(HCO3)2形式存在时,称为暂时硬水,当这种硬水加热煮沸时,碳酸氢盐会转化为沉淀除去;如果硬水中钙和镁主要以硫酸盐或氯化物等形式存在,则称为永久硬水,它们不能用煮沸的方法除去,但药剂法、离子交换法均可将钙和镁离子浓度减小,降低硬度,
所以答案是:bc;(3)a.以硫酸盐或氯化物形式存在时所引起的硬度,则称为永久硬度,加入石灰水只能降低Mg2+所形成的永久硬度,但转变为Ca2+形成的永久硬度,故a错误;
b.加石灰水发生:Ca(OH)2+Ca(HCO3)2=2CaCO3↓+2H2O,2Ca(OH)2+Mg(HCO3)2=2CaCO3↓+Mg(OH)2↓+2H2O,只能降低暂时硬度,不能降低永久硬度,故b误;
c.加石灰水发生反应:MgSO4+Ca(OH)2=Mg(OH)2↓+CaSO4; MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2 , 把部分Mg2+所形成的永久硬度转变为Ca2+形成的永久硬度,故c错误;
d.由c分析可知,加石灰水把部分Mg2+所形成的永久硬度转变为Ca2+形成的永久硬度,故d正确;
所以答案是:d;(4)取自江河湖泊中的淡水的处理顺序是:先沉淀、再过滤,最后消毒处理,顺序为②③①,所以答案是:②③①;(5)由流程图和实验目的可知,用工业废铁屑(含铜、碳、硅等)制取高铁酸钠,其中X、Y、Z是含铁化合物,碳酸钠溶液水解显碱性,洗涤废铁屑表面油污,油脂在碱性溶液中水解生成溶于水的物质得到粗铁,加入硫酸,铁和硫酸反应生成硫酸亚铁,过滤得到滤渣为铜和硅,滤液为硫酸亚铁,加入硫酸和过氧化氢氧化亚铁离子为铁离子,加入氢氧化钠用生成氢氧化铁沉淀,在氢氧化钠溶液中通入氯气生成高铁酸钠;
①废铁屑中加入Na2CO3热溶液的目的为清洗废铁屑表面的油污,所以答案是:清洗废铁屑表面的油污;
②粗铁加入硫酸,铁和硫酸反应生成硫酸亚铁,过滤得到滤渣为铜和硅,所以答案是:Cu、Si;
③Z为氢氧化铁,在氢氧化钠溶液中氯气氧化氢氧化铁为高铁酸钠,Cl2将Z氧化为Na2FO4 的化学方程式为10NaOH+3Cl2+2Fe(OH)3═2Na2FeO4+6NaCl+8H2O,
所以答案是:10NaOH+3Cl2+2Fe(OH)3═2Na2FeO4+6NaCl+8H2O;
④高铁酸钠消毒后的还原产物具有净水作用,其净水原理高铁酸盐在杀菌消毒时,本身被还原成Fe3+ , Fe3+易水解生成Fe(OH)3 , 具有胶体的性质,可吸附水中的悬浮杂质,而起到净化水的作用为,
所以答案是:高铁酸盐在杀菌消毒时,本身被还原成Fe3+ , Fe3+易水解生成Fe(OH)3 , 具有胶体的性质,可吸附水中的悬浮杂质,而起到净化水的作用;
⑤电解时阳极发生氧化反应,铁失电子生成高铁酸根离子,由电解质溶液配平电荷守恒可知电极反应方程式为Fe+8OH﹣﹣6e﹣═FeO42﹣+4H2O,
所以答案是:Fe+8OH﹣﹣6e﹣═FeO42﹣+4H2O.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】HIO4主要以H5IO6形式存在,H5IO6是白色晶体,易溶于水,具有很强的氧化性,在强酸溶液中能氧化Mn2+。
(1)请完成并配平下列离子反应。
__________Mn2++________H5IO6![]() __________
__________![]() +________
+________![]() +________H++________
+________H++________
(2)根据以上离子方程式判断H5IO6是________电离物质(填“易”或“难”)。
(3)上述反应,被氧化的元素是________(填元素符号),当1 mol Mn2+参加反应时,转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 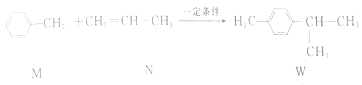 ,
,
下列说法不正确的是( )
A.M的所有原子可能在同一平面上
B.N的二氯代物有5种同分异构体(不考虑立体异构)
C.W的分子式为C10H14
D.M,N和W均能发生氧化反应和加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:银锌电池放电时总反应为Zn+Ag2O+H2O═Zn(OH)2+2Ag,用银锌电池作电源,在非水体系中完成钢制品上镀铝的原理如图所示,下列说法正确的是( ) 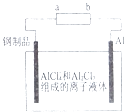
A.a电极的电极反应式为Ag2O+H2O+2e﹣=2Ag+2OH﹣
B.银锌电池的电解质溶液可用稀硫酸
C.银锌电池放电时,负极附近溶液的pH增大
D.Al电极上发生的电极反应式为Al+7AlCl4﹣﹣3e﹣=4Al2Cl4﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于溶液和胶体的叙述正确的是( )
A. 溶液呈电中性,而胶体是带电的,因而胶体可以产生电泳现象
B. 通电时,溶液溶质粒子移向两极,而胶体分散质移向同一极
C. 纳米碳的直径在1nm-100nm之间,因此其属于胶体
D. 三角洲的形成、夜晚霓虹灯、明矾净水及土壤保肥等均与胶体的性质有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S、N、Cl都是重要的非金属元素,下列说法正确是( )
A.98%的浓硫酸用等体积的水稀释后,硫酸的质量分数为49%
B.SO32﹣、ClO﹣、NO3﹣三种离子在溶液中因发生氧化还原反应而不能大量共存
C.浓硫酸、硝酸具有强氧化性,浓硝酸和浓盐酸易分解具有不稳定性
D.标况下,22.4L氯气与足量氢氧化钠溶液反应,转移的电子数为2NA个(NA为阿伏加德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从图中表示的各物质能量变化推断下列热化学方程式正确的是(a、b均为正数)( ) 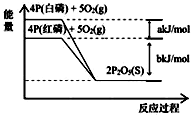
A.4P(白磷)+5O2(g)═2P2O5(S);△H1=+(a+b)kJ/mol
B.4P(红磷)+5O2(g)═2P2O5(S);△H2=﹣(b)kJ/mol
C.4P+5O2═2P2O5(s);△H3=+(a+b)kJ/mol
D.P(白磷)═P(红磷);△H4=+(a)kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com