
【题目】为探索工业中铝、铁、铜的合金废料的再利用,某同学设计了如下回收方案:
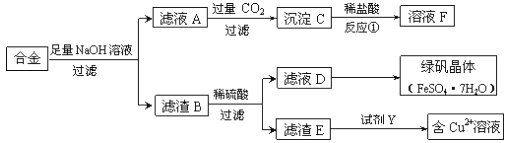
(1)操作①的名称是______________,滤渣B含有_______________(填化学式)。
(2)反应①的离子方程式是_________________________________。
(3)若要从滤液D中得到绿矾晶体,必须进行的实验操作是______________、冷却结晶、过滤、自然干燥,这一系列操作中没有用到的仪器有________(填序号)。
A.漏斗 B.坩埚 C.烧杯 D.玻璃棒
(4)试剂Y应该是一种________(填“氧化剂”或“还原剂”),它不可能是____(填序号)。
A.过氧化氢 B.氢气 C.氧气 D.铁
【答案】过滤Fe、CuCO2+AlO2-+2H2O=HCO3-+Al(OH)3↓蒸发浓缩B氧化剂BD
【解析】
Al和NaOH溶液反应生成可溶性的NaAlO2,Cu和Fe与NaOH溶液不反应,所以滤液A中含有NaAlO2,滤渣B是Cu和Fe,B和稀硫酸混合,Fe和稀硫酸反应生成FeSO4,Cu和稀硫酸不反应,所以滤渣E是Cu,D中含有FeSO4,Cu和稀硫酸、试剂Y生成硫酸铜,Y是强氧化剂,且不能引进新的杂质,为H2O2,A(NaAlO2)与过量的气体X反应生成沉淀C,沉淀C与盐酸反应生成溶液F,因此X为CO2,反应生成Al(OH)3,所以C是Al(OH)3,Al(OH)3和稀盐酸反应生成AlCl3,溶液F中含有AlCl3。
(1)根据上述分析,操作①为过滤,滤渣B中含有Fe、Cu,故答案为:过滤;Fe、Cu;
(2)反应①为偏铝酸钠和过量二氧化碳的反应,反应的离子方程式为CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,故答案为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓;
(3)若要从滤液D得到绿矾晶体,必须进行的实验操作步骤:蒸发浓缩、冷却结晶、过滤、自然干燥,在这一系列操作中用蒸发皿蒸发、用玻璃棒搅拌,在过滤中用玻璃棒引流、用烧杯盛放溶液,所以没有用到的仪器有坩埚,故选B,故答案为:蒸发浓缩;B;
(4)试剂Y应该是一种氧化剂,能将铜氧化为铜离子,所以它不可能是H2或Fe,故选BD,故答案为:氧化剂;BD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列物质进行一氯取代后,生成的产物只有2种的是
A.(CH3)2CHCH(CH3)2
B.(CH3)3CCH2CH3
C.(CH3CH2)2CHCH3
D.(CH3)4C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:

已知:HCl的沸点是—85.0℃,HF的沸点是19.5℃。
(1)第①步反应中无水HF的作用是____________、_____________。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的_______溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PF5极易与水反应,其产物为两种酸,写出PF5与水反应的化学方程式:________________________________________。
(3)第④步分离采用的方法是_______;第⑤步分离尾气中HF、HCl采用的方法是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2A(g)+3B(g)![]() 2C(g)+zD(g),现将2 mol A与2 mol B混合于2 L的密闭容器中,2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是
2C(g)+zD(g),现将2 mol A与2 mol B混合于2 L的密闭容器中,2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是
A. v(C)=0.2 mol·L-1·s-1 B. z=1
C. B的转化率为25% D. C平衡时的浓度为0.5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(s)cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是 ( )
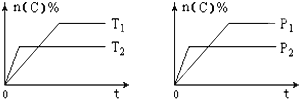
A. P1 > P2
B. 该反应的ΔH < 0
C. 化学方程式系数a>c+d
D. 使用催化剂,C的物质的量分数增加
【答案】B
【解析】A.先拐先平数值大,由右图可知,P2>P1,故A错误;B. 先拐先平数值大,由左图可知,T2>T1,升高温度C的物质的量分数减小,说明升高温度平衡逆向移动,则该反应为放热反应,ΔH < 0,故B正确;C. 由右图可知,P2>P1,增大压强C的物质的量分数减小,说明增大压强平衡逆向移动,则逆反应方向为气体体积减小的方向,所以化学方程式系数a<c+d,故C错误;D. 使用催化剂不能使化学平衡发生移动,则C的物质的量分数不变,故D错误;答案选B。
【题型】单选题
【结束】
22
【题目】25℃时,0.1 molL-1溶液的pH如下表,下列有关说法正确的是 ( )
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A. 酸性强弱:HF<H2CO3
B. ①和②中溶质均未水解
C. 由水电离产生的c(H+):①>②
D. ④溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)= c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某饱和一元醛发生银镜反应时可析出21.6克银,等量的此醛完全燃烧可生成8.96升CO2(标准状况),则该醛是
A. 乙醛 B. 2—甲基丁醛 C. 丁醛 D. 己醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是( )
A.含有大量Ba2+的溶液:Cl﹣ K+ SO42﹣ CO32﹣
B.含有大量H+的溶液:Mg2+ Na+ SO42﹣ CO32﹣
C.含有大量 OH﹣的溶液:Cu2+ NO3﹣ SO42﹣ CO32﹣
D.含有大量Na+的溶液:H+ K+ SO42﹣ NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,H2SO3 Ka1=1.5×10-2 Ka2=1.0×10-7 H2CO3 Ka1=4.4×10﹣7 Ka2=4.7×10-11 HClO Ka=3.0×10﹣8 饱和 NaClO 溶液的浓度约为 3mol/L.
(1)室温下,0.1mol/L NaClO 溶液的 pH _____0.1mol/L Na2SO3 溶液的 pH.(选填“大于”、小于”或“等于”)。浓度均为 0.1mol/L 的 Na2SO3 和 Na2CO3 的混合溶液中,SO32﹣、CO32﹣、HSO3﹣、HCO3﹣浓度从大到小的顺序为_______________。
(2)下列离子反应正确的有:__________。
A.2HCO3﹣+SO2═SO32﹣+2CO2+H2O B.ClO﹣+CO2+H2O═HClO+HCO3﹣
C.ClO﹣+SO2+H2O═HClO+HSO3﹣ D.2ClO﹣+SO2+H2O═2HClO+SO32﹣
(3)某消毒液的有效成分为 NaClO,还含有一定量的 NaOH 等,下列用来解释事实的方程式中不合理的是:__________。
A.该消毒液可用 NaOH 溶液吸收 Cl2 制备:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O
B.室温下,该消毒液的 pH 约为12,主要是因为:ClO﹣+H2O![]() HClO+OH﹣
HClO+OH﹣
C.该消毒液加白醋生成 HClO,可增强漂白作用:H++ClO﹣═HClO
D.该消毒液与洁厕灵(主要成分为 HCl)混用,产生 Cl2:2H++Cl﹣+ClO﹣═Cl2↑+H2O
(4)25℃时,0.1mol 下列气体分别与 1L0.l mol·L﹣1 的 NaOH 溶液反应,形成的溶液的pH 由大到小的顺序为:_________(用 A、B、C 表示).
A.SO3 B.SO2 C.CO2
(5)下列说法不正确的是(_____)
A.一定温度下,pH相同的氨水和氢氧化钠等体积混合后溶液pH不变
B.含等物质的量的 NaClO、NaHCO3 混合溶液中:c(HClO)+c(ClO﹣)=c(HCO3﹣)+c(H2CO3)+c(CO32﹣)
C.CH3COOH 溶液加水稀释后,溶液中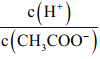 的值减小
的值减小
D.水中加入金属钠,虽反应生成了强碱氢氧化钠,但促进了水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置,下列叙述不正确的是( )

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为Cu2++2e-![]() Cu
Cu
C. 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com