
【题目】下列关于甲、乙、丙、丁四种有机物的说法正确的是
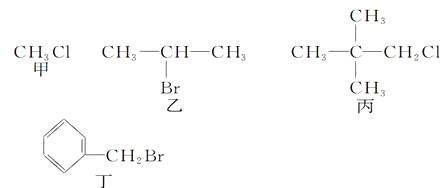
A. 甲、乙、丙、丁中分别加入氯水,均有红棕色液体生成
B. 甲、乙、丙、丁中加入NaOH溶液共热,然后加入稀硝酸调至溶液呈酸性,再滴入AgNO3溶液,均有沉淀生成
C. 甲、乙、丙、丁中加入NaOH的醇溶液共热,然后加入稀硝酸调至溶液呈酸性,再滴入AgNO3溶液,均有沉淀生成
D. 乙发生消去反应得到两种烯烃
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知15P、33As位于同一主族.下列关系正确的是( )
A. 原子半径:As>Cl>P B. 非金属性:Cl>S>As
C. 热稳定性:HCl>AsH3>PH3 D. 酸性:H3AsO4>H2SO4>H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列叙述错误的是
A.高纯硅可用于制作光感电池
B.氢氧化铝可用于中和过多胃酸
C.绿色化学要求从源头上消除或减少生产活动对环境的污染
D.泡沫灭火器可用于一般的起火,也适用于电器起火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是指微粒直径为几纳米(1nm=1×10-9m)到几十纳米的材料。如将不同纳米材料分散到水中,得到的分散系具有的性质中,不可能有的是( )
A.一定能通过半透膜 B.一定能通过滤纸
C.有丁达尔现象 D.有电泳现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是现行中学化学教科书中元素周期表的一部分,表中的每个编号表示一种元素,请根据要求回答问题。
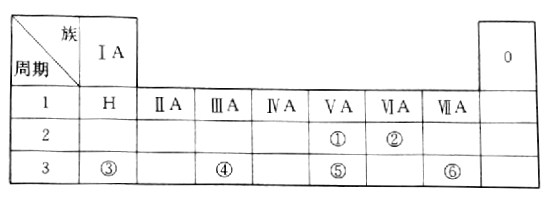
(1)② 表示的元素是______(填元素符号);
(2)①、⑤两种元素的原子半径大小为①______⑤(填“< ”或“>”);
(3)③、④两种元素的金属性强弱顺序为:③______④(填“< ”或“>”);
(4)写出③与⑥两种元素所形成化合物的化学式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格: 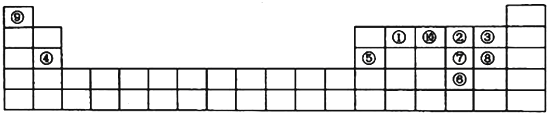
(1)在这10种元素中,非金属性最强的是(填序号);
(2)元素②⑧⑨以原子个数比1:1:1形成的化合物的结构式为 , 元素②与⑨形成的18e﹣化合物的电子式;
(3)②、⑨、⑩三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M中含有的化学键类型有;
(4)比较元素⑦⑧形成的气态氢化物的稳定性:>(用化学式表示)
(5)元素⑤的氧化物与氢氧化钠溶液反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化钠固体易吸收空气中的二氧化碳而变质。取4.65 g已部分变质的氢氧化钠固体与36.5 g 10%的盐酸恰好完全反应后,将溶液蒸干,所得固体的质量是( )
A. 11.7 g B. 5.85 g C. 4.65 g D. 8.3 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2SO4是常见的化肥和化工原料,受热易分解.某兴趣小组拟探究其分解产物.
[查阅资料](NH4)2SO4在260℃和400℃时分解产物不同.
[实验探究]该小组拟选用下图所示装置进行实验(夹持和加热装置略)
实验1:连接装置A﹣B﹣C﹣D,检查气密性,按图示加入试剂(装置B盛0.5000mol/L盐酸70.00mL).通入N2排尽空气后,于260℃加热装置A一段时间,停止加热,冷却,停止通入N2 , 品红溶液不褪色.已知中和装置B中剩余盐酸需0.2000mol/L NaOH溶液25.00mL,且中和后的溶液中无SO42﹣ .
(1)仪器X的名称是;
(2)装置B内溶液吸收气体的物质的量是mol;
实验2:连接装置A﹣D﹣B,检查气密性,按图示重新加入试剂.通入N2排尽空气后,于400℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2 . 观察到装置A、D之间的导气管内有少量白色固体.经检验,该白色固体和装置D内溶液中有SO32﹣ , 无SO42﹣ . 进一步研究发现,气体产物中无氮氧化物.
(3)检验装置D内溶液中有SO32﹣ , 无SO42﹣的实验操作和现象是;
(4)装置B内溶液吸收的气体是;
(5)(NH4)2SO4在400℃分解的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
锌的质量/g | 锌的形状 | 温度/℃ | 锌完全溶解的时间/s | |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | t1 |
E | 2 | 颗粒 | 15 | t2 |
F | 2 | 粉末 | 15 | t3 |
G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
(1)反应的离子方程式是 , 该反应为反应(填“放热”或“吸热”).
(2)t1=s,完成下列时间对温度的曲线图(纵轴表示时间,横轴表示温度) .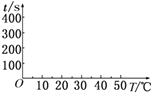
(3)利用所画的曲线图和相关数据,可得出该反应中温度影响反应速率的规律是 .
(4)t1(填“>”或“<”)t4 , 原因是 .
t2t3(填“>”或“<”),原因是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com