
【题目】下列过程要吸收热量的是
A.甲烷在空气中燃烧 B.碳酸钙受热分解
C.镁条溶于盐酸 D.浓硫酸溶于水
科目:高中化学 来源: 题型:
【题目】分散质粒子大小在__________之间的分散系,叫胶体。制备 Fe(OH)3胶体是向煮沸的蒸馏水中逐滴加入_________饱和溶液,继续煮沸至溶液呈_________, 停 止 加 热 。 制 备 Fe(OH)3 胶 体 的 化 学 方 程 式 为: _________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”的核心是在化学反应过程中或化工生产中,尽量减少使用或彻底消除有害物质,下列做法中,符合“绿色化学”理念的是( )
A.生产和使用剧毒农药
B.化工厂产生的废气向高空排放
C.利用氢气作高能燃料
D.造纸厂利用二氧化硫进行纸浆漂白
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在接触法制硫酸的生产中,SO2转化成SO3转化率的大小直接决定生产效率。某研究小组用下图装置模拟生产过程中测定SO2转化成SO3的转化率。已知SO3的熔点是16.8℃,沸点是44.8℃。发生装置中所涉及反应的化学方程式为:
Na2SO3(s)+H2SO4(75%)=Na2SO4+SO2↑+H2O
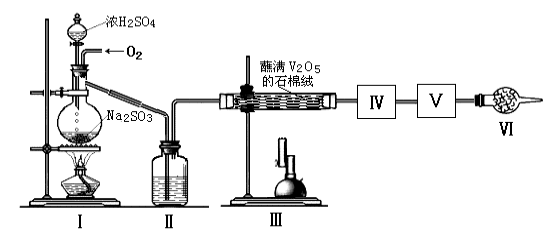
(1)Ⅱ中的试剂是 ,仪器Ⅵ的名称为 。
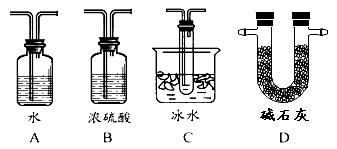
(2)根据实验需要,应该在Ⅳ、Ⅴ处连接合适的装置。请从下图A~D装置中选择最适合装置并将序号填入下面的空格中,Ⅳ、Ⅴ处连接的装置分别是 、 。
(3)为了提高SO2的转化率,实验时在:①滴加浓硫酸;②加热催化剂的步骤中,应采取的操作是先_______后_________(填编号)。
(4)实验结束后,如果把收集SO3的试管敞口露置于空气中,能够看到管口有大量的白雾,产生此现象的原因是 。
(5)用18.9gNa2SO3粉末与足量较浓的硫酸进行此实验,当反应结束时,继续通入O2一段时间后测得装置Ⅴ增重了7.2g,则实验测得SO2的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84 g/cm3)配制100 mL 1.0 mol·L-1稀硫酸,若实验仪器有:
A、100mL量筒
B、托盘天平
C、玻璃棒
D、50mL容量瓶
E、10mL量筒
F、胶头滴管
G、50mL烧杯
H、100mL容量瓶
(1)需量取浓硫酸的体积为 mL。
(2)实验时选用的仪器有 (填字母)
(3)下列操作会导致所配溶液浓度偏低的是________(填序号)
①在烧杯中搅拌溶液时,有少量液体溅出
②定容摇匀后,发现溶液液面低于刻度线,又滴加蒸馏水至刻度线
③容量瓶使用前未进行干燥
④没有洗涤溶解时所用的烧杯和玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝硅合金材料性能优良。铝土矿(含30%SiO2、40.8% Al2O3、和少量的 Fe2O3等)干法制取该合金的工艺如下:
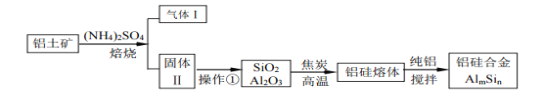
(1)铝硅合金中若含有铁,会影响其抗腐蚀性能,原因是_____________________
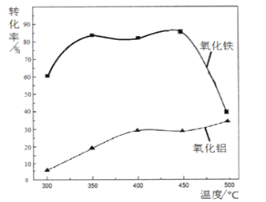
(2)焙烧除铁反应时,Fe2O3转化为NH4Fe(SO4 )2,Al2O3 少部分发生类似反应,写出Fe2O3反应的化学方程式:_____________________。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜的焙烧温度是________________
(3)若操作①所得的溶液中加入过量的NaOH溶液,含铝微粒发生的离子反应方程式是:_______________________。
(4)用焦炭还原SiO2、Al2O3会产生SiC等中间体。写出中间体SiC再与Al2O3生成硅、铝单质的化学反应方程式,_________________________。
(5)已知25℃ Ksp[Al(OH)3]=1.0×10-33 , Ksp[Fe(OH)3]=4.0×10-38,向FeCl3和AlCl3的混合溶液中逐滴滴入NaOH溶液,生成Al(OH)3和Fe(OH)3 沉淀,当两种沉淀共存时,上层清液中c(Al3+):c(Fe3+)==___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图所示的物质转化关系中,A是常见的气态氢化物,其水溶液呈碱性,B是能使带火星的木条复燃的无色无味气体, G是一种红色金属单质。(部分反应中生成物没有全部列出,反应条件未列出)
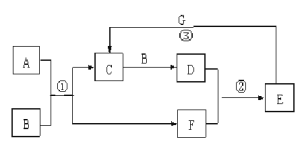
请回答下列问题:
(1)反应①的化学方程式为 。当有1molA参加反应时,转移 mol电子。
(2)反应②的化学方程式为 。
(3)反应③的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com