
我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如图
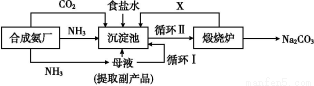
(1)上述生产纯碱的方法称 ,副产品的一种用途为 。
(2)沉淀池中发生的化学反应方程式是 。
(3)写出上述流程中X物质的分子式 。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是 。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加 。
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
a.增大NH4+的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(1)联合制碱法或侯德榜制碱法 用作化肥或电解液或焊药等(其他合理答案均给分)
(2)NH3+CO2+H2O+NaCl NH4Cl+NaHCO3↓
NH4Cl+NaHCO3↓
(3)CO2 (4)I 过滤
(5)稀硝酸和硝酸银溶液 (6)ac
【解析】本题主要考查侯氏制碱法的生产原理及生产工艺、Cl-检验等。(1)侯氏制碱法的副产物是NH4Cl,可作化肥等;(2)根据联合制碱法的生产原理,可知向食盐水中通入氨气是为了得到碱性溶液,以吸收更多的CO2,当CO2过量时发生反应:NH3+CO2+H2O NH4HCO3,NaCl+NH4HCO3
NH4HCO3,NaCl+NH4HCO3 NaHCO3↓+NH4Cl;(3)当NaHCO3在煅烧炉中受热分解:2NaHCO3
NaHCO3↓+NH4Cl;(3)当NaHCO3在煅烧炉中受热分解:2NaHCO3 Na2CO3+CO2↑+H2O,故X为CO2;(4)因为氯化钠最后剩余在母液中,所以要提高NaCl的利用率必须将过滤出NaHCO3后的母液循环利用;(5)要检验碳酸钠中是否混有NaCl,只需向溶液中加硝酸酸化的AgNO3,看是否有白色沉淀生成即可;(6)增大铵根的浓度有利于氯化铵析出来,所以选项a正确;通入氨气使溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度,所以选项c正确,选项b错误。
Na2CO3+CO2↑+H2O,故X为CO2;(4)因为氯化钠最后剩余在母液中,所以要提高NaCl的利用率必须将过滤出NaHCO3后的母液循环利用;(5)要检验碳酸钠中是否混有NaCl,只需向溶液中加硝酸酸化的AgNO3,看是否有白色沉淀生成即可;(6)增大铵根的浓度有利于氯化铵析出来,所以选项a正确;通入氨气使溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度,所以选项c正确,选项b错误。


科目:高中化学 来源:2014高考化学名师选择题专练 元素周期表元素周期律练习卷(解析版) 题型:选择题
R、X、Y、M、Z五种短周期主族元素的原子半径依次减小,X、Y、Z的电子层数之和为5,X元素原子的最外层电子数是它的电子层数的2倍,Y元素原子的最外层电子数是X和Z两元素原子最外层电子数的总和,M是地壳中含量最多的元素,R与Z的最外层电子数相同。下列叙述正确的是( )
A.Z与M形成的化合物中不可能含有非极性键
B.对应氢化物的热稳定性:X>Y>M
C.单质的还原性:R>M>Y>X
D.X、Y、M、Z四种元素组成的离子化合物受热易分解
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 化学实验练习卷(解析版) 题型:实验题
某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
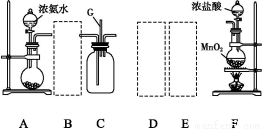
(1)装置F中发生反应的离子方程式为 。
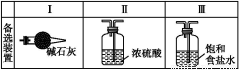
(2)装置A中的烧瓶内固体可选用 (填以下选项的代号)。
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:B ,D ,E (均填编号)。
(4)氯气和氨气在常温下相混就会反应生成氯化铵和氮气,装置C内出现浓厚的白烟并在容器内壁凝结,请设计实验方案鉴定该固体就是氯化铵: 。
(5)从装置C的出气管口处逸出的尾气可能含有污染环境的气体,如何处理?
。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 选修3物质结构与性质练习卷(解析版) 题型:选择题
PH3是一种无色剧毒气体,其分子结构和NH3相似,但P-H键键能比N-H键键能低。下列判断中错误的是( )
A.PH3分子呈三角锥形
B.PH3分子是极性分子
C.PH3沸点低于NH3沸点,因为P—H键键能低
D.PH3分子稳定性低于NH3分子,因为N—H键键能高
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 选修2化学与技术练习卷(解析版) 题型:选择题
下列说法不正确的是( )
A.使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺都符合绿色化学的思想
B.氨基酸是人体必需的营养物质,其晶体主要以内盐形式存在,调节溶液的pH可改变它的溶解度
C.石油裂解、煤的气化、橡胶老化、海水制镁、纯碱晶体风化、纤维素制火棉等过程中都包含化学变化
D.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物”,PM2.5在空气中只形成气溶胶
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 选修2化学与技术练习卷(解析版) 题型:选择题
工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法正确的是( )
选项污染物处理措施方法类别
A废酸加生石灰中和物理法
BCu2+等重金属离子加硫酸盐沉降化学法
C含苯废水用活性炭吸附物理法
D含纯碱的废水加石灰水反应化学法
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题9溶液中的电离平衡练习卷(解析版) 题型:选择题
针对0.1 mol·L-1的醋酸溶液,下列分析判断正确的是( )
A.升高温度,溶液的pH会增大
B.加入少量固体NaOH,溶液中c(CH3COO-)+c(OH-)>c(Na+)+c(H+)
C.加入少量0.2 mol·L-1的硫酸溶液,水电离产生的c(H+)减小
D.与0.1 mol·L-1的NaOH溶液等体积混合后,溶液中c(CH3COO-)=c(Na+)
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题8化学反应速率与化学平衡练习卷(解析版) 题型:选择题
可逆反应:A+3B 2C+2D(各物质均为气体)在不同情况下测得有下列4 种反应速率,其中反应最快的是( )
2C+2D(各物质均为气体)在不同情况下测得有下列4 种反应速率,其中反应最快的是( )
A.vD=0.4 mol/(L·s)B.vC=0.5 mol/(L·s)
C.vB=0.6 mol/(L·s)D.vA=0.15 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题4氧化还原反应练习卷(解析版) 题型:选择题
三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体。它无色、无臭,在潮湿的空气中能发生下列反应:3NF3+5H2O 2NO+HNO3+9HF,下列有关说法正确的是( )
2NO+HNO3+9HF,下列有关说法正确的是( )
A.反应中NF3是氧化剂,H2O是还原剂
B.反应中被氧化与被还原的原子物质的量之比为2∶1
C.若反应中生成0.2 mol HNO3,则反应共转移0.2 mol e-
D.NF3在潮湿的空气中泄漏会产生白雾、红棕色气体等现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com