
【题目】I:某校课外小组同学制备Fe(OH)3胶体,并研究该胶体的性质。
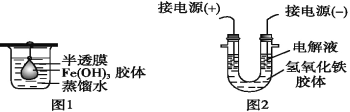
(1)该小组同学采用了以下操作制备胶体,请将空白处填写完整。
取一个烧杯,加入20 mL蒸馏水,加热至沸腾,然后向烧杯中滴加1~2 mL饱和______溶液,继续煮沸,待溶液呈____后,停止加热。
(2)将制得的胶体放入半透膜制成的袋内,如图1所示,放置2 min后,取少量半透膜外的液体于试管中,置于暗处,用一束强光从侧面照射,观察_____(填“有”或“无”)丁达尔效应;再向烧杯中加入用稀硝酸酸化的硝酸银溶液,可观察到的现象为______________。
(3)将半透膜内的液体倒入U形管中,如图2所示,在液体上方加入少量电解液以保护胶体,接通直流电后,观察到的现象是____(填“阴”或“阳”)极附近颜色逐渐变深,其原因是_______。
II:回答下列问题:
(1)“铝热反应”中的铝热剂通常是Fe2O3和Al粉的混合物,高温反应时可放出大量的热。请写出该反应的化学方程式_________________________。
(2)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为______________。
【答案】 FeCl3 红褐色 无 有白色沉淀产生 阴 Fe(OH)3胶体粒子带正电荷 2Al+Fe2O3![]() Al2O3+2Fe 2Fe3++10OH-+3ClO-=2FeO42-+3Cl-+5H2O或2Fe(OH)3+4OH-+3ClO-=2FeO42-+3Cl-+5H2O
Al2O3+2Fe 2Fe3++10OH-+3ClO-=2FeO42-+3Cl-+5H2O或2Fe(OH)3+4OH-+3ClO-=2FeO42-+3Cl-+5H2O
【解析】I、(1)向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈红褐色,即制得Fe(OH)3胶体;
(2)胶体不能透过半透膜,而溶液是可以的,据此判断;
(3)氢氧化铁胶体的胶粒带正电荷,向阴极移动。
II、(1)Fe2O3和Al发生铝热反应生成氧化铝和铁。
(2)根据电子得失守恒、原子守恒以及电荷守恒书写离子方程式。
I、(1)制备氢氧化铁胶体应该用新制的饱和氯化铁溶液滴入沸水中,继续加热至出现红褐色后即可;
(2)胶体不能透过半透膜,而溶液是可以的。所以半透膜外的液体是不能产生丁达尔效应的。由于溶液中含有氯离子,因此向烧杯中加入用稀硝酸酸化的硝酸银溶液,可观察到的现象为有白色沉淀产生;
(3)氢氧化铁胶体的胶粒带正电荷,所以向阴极移动,即阴极附近溶液颜色加深;
II、(1)“铝热反应”中的铝热剂通常是Fe2O3和Al粉的混合物,高温反应时可放出大量的热,生成氧化铝和铁,该反应的化学方程式为2Al+Fe2O3![]() Al2O3+2Fe。
Al2O3+2Fe。
(2)FeCl3与KClO在强碱性条件下反应可制取K2FeO4,反应中铁元素化合价从+3价升高到+6价,失去3个电子,氯元素化合价从+1价降低到-1价,得到2个电子,根据电子得失守恒可知氧化剂与还原剂的物质的量之比是3:2,因此根据原子守恒以及电荷守恒可知反应的离子方程式为2Fe3++10OH-+3ClO-=2FeO42-+3Cl-+5H2O或2Fe(OH)3+4OH-+3ClO-=2FeO42-+3Cl-+5H2O。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】乙二胺(H2NCH2CH2NH2),无色液体,有类似氨的性质。已知:25℃时,Kb1=10-4.07Kb2=10-7.15;乙二胺溶液中各含氮微粒的分布分数δ(平衡时某含氮微粒的浓度占各含氮微粒浓度之和的分数)随溶液pH的变化曲线如右图。下列说法错误的是

A. H2NCH2CH2NH2在水溶液中第一步电离的方程式为:H2NCH2CH2NH2+H2O![]() H2NCH2CH2NH3++OH-
H2NCH2CH2NH3++OH-
B. 曲线Ⅰ代表的微粒符号为[H3NCH2CH2NH3]2+
C. 曲线Ⅰ与曲线Ⅱ相交点对应pH=4.07
D. 在0.1mol·L-1 H2NCH2CH2NH3Cl溶液中各离子浓度大小关系为c(Cl-)>(H2NCH2CH2NH3+) >c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若下图表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。
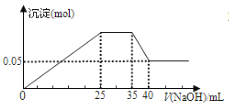

① ②
下列各表述与示意图一致的是( )
A. 图①三种离子的物质的量之比为:n(Mg2+):n(Al3+):n(NH4+)=2:3:2
B. 图②中曲线表示某反应过程的能量变化, 若使用催化剂,B点会降低
C. 图①中使用的NaOH的浓度为2 mol/L
D. 图②中物质A反应生成物质C,ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ca(OH)2和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42—(aq)+ Ca(OH)2(s) ![]() CaWO4(s)+2OH-(aq)。
CaWO4(s)+2OH-(aq)。
(1)如图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线。

①计算T1时Ksp(CaWO4)=________。
②T1________T2(填“>”、“=”或“<”)。
(2)反应Ⅰ的平衡常数K理论值如表所示:
温度/℃ | 25 | 50 | 90 | 100 |
K | 79.96 | 208.06 | 222.88 | 258.05 |
①该反应平衡常数K的表达式为________________。
②该反应的ΔH________0(填“>”、“=”或“<”)。
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值相距甚远。50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4)=c(NaOH)=0.5mol·L-1]中,加入过量Ca(OH)2,反应达到平衡后WO42—的沉淀率为60%,计算实验测得的平衡常数________________。
(3)制取钨酸钙时,适时向反应混合液中添加适量盐酸,分析作用: __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表示不正确的是( )
A. 氮化镁:MgN
B. Ca(OH)2的电离方程式:Ca(OH)2=Ca2++2OH
C. 中子数为18的氯原子:![]()
D. 氟化钠的电子式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在NaCl、MgCl2和MgSO4三种盐配成的混合溶液中,若Na+的浓度为0.1 mol/L,Mg2+的浓度为0.25 mol/L,Cl-的浓度为0.2 mol/L, 则SO42-的物质的量浓度为( )
A.0.5 mol/LB.0.2 mol/L
C.0.45 mol/LD.0.25 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com