
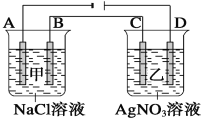
【题目】如下图甲、乙两个容器中,分别加入0.1 mol·L-1的NaCl溶液与0.1 mol·L-1的AgNO3溶液后,以Pt为电极进行电解时,在A、B、C、D各电极上生成物的物质的量之比为( )
A. 2∶2∶4∶1
B. 2∶3∶4∶1
C. 1∶4∶2∶2
D. 1∶1∶1∶1
【答案】A
【解析】根据图示,得到A是阴极,该电极上是氢离子得电子,B是阳极,该电极上是氯离子失电子,C是阴极,该电极上是析出金属银,D是阳极,该电极上产生氧气,根据电极反应式以及电子守恒进行相应的计算。
根据图示,得到A是阴极,该电极上是氢离子得电子,2H++2e-=H2↑,B是阳极,该电极上是氯离子失电子,级2Cl--2e-=Cl2↑,C是阴极,该电极上是析出金属银,Ag++e-=Ag,D是阳极,该电极上产生氧气,级4OH--4e-=O2↑+2H2O,各个电极上转移电子的物质的量是相等的,设转以电子1mol,所以在A、B、C、D各电极上生成的物质的量之比为0.5:0.5:1:0.25=2:2:4:1,故选A。


科目:高中化学 来源: 题型:
【题目】实验室通过如下步骤,测定某有机化合物A的结构:

(1)将一定量的有机物A置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗O26.72L(标准状况下),则该物质的实验式是_____.
(2)实验室可以用_____(填仪器名称)测定有机物的相对分子质量.已知A的相对分子质量测定结果如图1所示,根据图示结果,推测A的分子式是_____.
(3)根据价键理论,A可能的结构简式有_____.
(4)利用核磁共振氢谱的峰值可以确定有机物分子中氢原子的种类和数目.经测定,A的核磁共振氢谱图如图2所示,则A的结构简式为_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
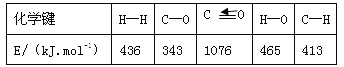
由此计算△H1= kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3= kJ·mol-1。
(2)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。
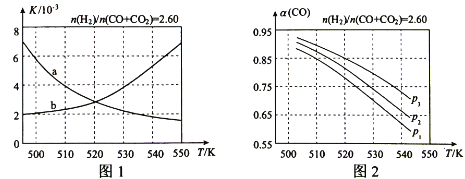
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而 (填“增大”或“减小”),其原因是 。图2中的压强由大到小为_____,其判断理由是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各组物质中,找出合适的序号填在对应的空格内:
①白磷和红磷 ②NO2和N2O4 ③12C和14C ④![]() 和
和 ![]() ⑤C60和金刚石 ⑥异戊烷和新戊烷
⑤C60和金刚石 ⑥异戊烷和新戊烷 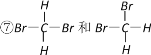
⑴互为同位素的是_____________;⑵互为同分异构体的是__________;
⑶互为同素异形体的是_________;⑷同一种物质的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A在通常状况下是一种相对分子量为28的气体,A通过加聚反应可以得到F,F常作为食品包装袋的材料。有机物A、B、C、D、E、F有如图所示的关系:
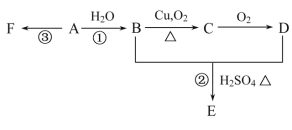
(1)A的分子式为_____,用途为____________________。
(2)写出反应①的化学方程式_____________________,该反应的类型是______。
写出反应②的化学方程式___________________,该反应的类型是_________。
写出反应③的化学方程式____________________________。
(3)写出B生成C的方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法中正确的有:
A. 2.4g金属镁与足量盐酸反应,转移电子的数目为0.1NA ;
B. 1L1mol/L的CaCl2溶液中含Cl-的数目为NA;
C. 在25℃、1.01×105Pa的条件下,2.24L H2中含有的分子数小于0.1NA;
D. 22 g CO2与标准状况下11.2 L H2O含有相同分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)NOx和SO2在空气中存在下列平衡:
2NO(g)+ O2(g) 2NO2(g) △H= -112 kJ·mol-1,
2SO2(g)+ O2 (g) 2SO3(g) △H= -196 kJ·mol-1;
SO2通常在NO2的存在下,进一步被氧化,生成SO3。写出NO2和SO2反应的热化学方程式为________________________________。
(2)烟气中的SO2可以用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)

①图中a极要连接电源的_______(填“正”或“负”)极,C口流出的物质是_______。
②SO32-放电的电极反应式为_____________________________________。
(3)常温下,烟气中SO2被NaOH溶液吸收可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是_____________________________________(写出主要反应的离子方程式),该溶液中c(Na+)_________ 2c(SO32-)+ c(HSO3-)(填“>”“<”或“=”);
②常温下,0.1mol/L的NaHSO3溶液的pH=6,则c(SO32-)- c(H2SO3)= _________ mol/L(填写准确数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核安全与放射性污染防治已引起世界各国的广泛重视。在爆炸的核电站周围含有放射性物质碘131和铯137。碘131一旦被人体吸入,可能会引发甲状腺疾病。
(1)Cs(铯)的价电子排布式为6s1,与铯同主族的前四周期(包括第四周期)的三种元素X、Y、Z的第一电离能如下表:
元素代号 | X | Y | Z |
第一电离能/(kJ·mol-1) | 520 | 496 | 419 |
上述三种元素X、Y、Z的元素符号分别为________,基态Z原子的核外电子排布式为________,X形成的单质晶体中含有的化学键类型是________。
(2)F与I同主族,BeF2与H2O都是由三个原子构成的共价化合物分子,二者分子中的中心原子Be和O的杂化方式分别为________、________,BeF2分子的立体构型是________,H2O分子的立体构型是________。
(3)与碘同主族的氯具有很强的活泼性,能形成大量的含氯化合物。BCl3分子中B—Cl键的键角为________。
(4)131I2晶体的晶胞结构如图甲所示,该晶胞中含有________个131I2分子;KI的晶胞结构如图乙所示,每个K+紧邻________个I-。

甲 乙
(5)KI晶体的密度为ρ g·cm-3,K和I的摩尔质量分别为MK g·mol-1和MIg·mol-1,原子半径分别为rKpm和rIpm,阿伏加德罗常数的值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com