
【题目】用NA表示阿伏加德罗常数,下列说法中正确的有:
A. 2.4g金属镁与足量盐酸反应,转移电子的数目为0.1NA ;
B. 1L1mol/L的CaCl2溶液中含Cl-的数目为NA;
C. 在25℃、1.01×105Pa的条件下,2.24L H2中含有的分子数小于0.1NA;
D. 22 g CO2与标准状况下11.2 L H2O含有相同分子数
【答案】C
【解析】
A. 2.4 g金属镁与足量盐酸反应,转移电子的数目为0.2NA,故A错误;B. CaCl2![]() Ca2++2Cl-,1L 1 mol·L-1的CaCl2溶液中含Cl-的数目为2NA,故B错误;C. 在25℃、1.01×105Pa的条件下,气体摩尔体积大于22.4L/mol,所以2.24 L H2的物质的量小于0.1mol,含有的分子数小于0.1 NA,故C正确;D. 22 g CO2的物质的量是0.5mol,标准状况下水呈非气态,11.2 L H2O的物质的量大于0.5mol,所以22 g CO2与标准状况下11.2 L H2O含有的分子数不同,故D错误。故选C。
Ca2++2Cl-,1L 1 mol·L-1的CaCl2溶液中含Cl-的数目为2NA,故B错误;C. 在25℃、1.01×105Pa的条件下,气体摩尔体积大于22.4L/mol,所以2.24 L H2的物质的量小于0.1mol,含有的分子数小于0.1 NA,故C正确;D. 22 g CO2的物质的量是0.5mol,标准状况下水呈非气态,11.2 L H2O的物质的量大于0.5mol,所以22 g CO2与标准状况下11.2 L H2O含有的分子数不同,故D错误。故选C。


科目:高中化学 来源: 题型:
【题目】下列曲线图(纵坐标为沉淀的量,横坐标为加入物质的量)与对应的选项相符合的是( )


A.向1 L浓度均为0.1 mol·L-1的Ba(OH)2、NaAlO2混合溶液中加入0.1 mol·L-1的稀H2SO4
B.向1 L浓度分别为0.1 mol·L-1和0.3 mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的稀NaOH溶液
C.向烧碱溶液中滴加明矾溶液
D.向AlCl3溶液中滴加过量氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池放电、充电时的反应为Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2 ,下列推断中正确的是( )
Fe(OH)2+2Ni(OH)2 ,下列推断中正确的是( )
A. 放电时,Fe为正极,Ni2O3为负极
B. 充电时,阴极上的电极反应式是Fe(OH)2+2e- + 2H+ = Fe+2H2O
C. 充电时,Ni(OH)2为阳极,发生还原反应
D. 该蓄电池的电极是浸在某种碱性电解质溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图甲、乙两个容器中,分别加入0.1 mol·L-1的NaCl溶液与0.1 mol·L-1的AgNO3溶液后,以Pt为电极进行电解时,在A、B、C、D各电极上生成物的物质的量之比为( )
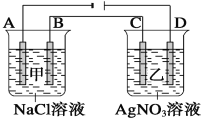
A. 2∶2∶4∶1
B. 2∶3∶4∶1
C. 1∶4∶2∶2
D. 1∶1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图:
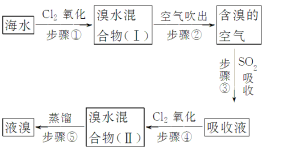
(1)步骤①反应的离子方程式是_____________________________。
(2)步骤③反应的化学方程式是______________________________。
(3)从理论上考虑,下列也能吸收Br2的是________。
A.NaOH B.FeCl2 C.Na2SO3 D.H2O
(4)步骤⑤蒸馏的过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时还能制得氢气,具体流程如下:

下列说法正确的是
A. 分离器中的物质分离操作为过滤
B. 膜反应器中,增大压强有利于提高HI的分解速率和平衡转化率
C. 该工艺中I2和HI的相互转化体现了“碘循环”
D. 碘循环工艺的总反应为2SO2+4H2O+I2 == H2+2H2SO4+ 2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 用碳酸氢钠溶液检验水杨酸中的羧基: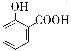 +2HCO3-→
+2HCO3-→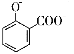 +2H2O+2CO2↑
+2H2O+2CO2↑
B. 在NaHCO3溶液中加入过量Ba(OH)2溶液:HCO3—+Ba2++OH—= BaCO3↓+H2O
C. 向Mg(HCO3)2溶液中加入过量NaOH溶液,产生白色沉淀:Mg2++2HCO3-+2OH- = MgCO3↓+2H2O
D. 用高锰酸钾溶液滴定草酸:2MnO4-+16H++5C2O42- = 2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成的pH列于下表(已知:偏铝酸钡易溶于水)。以下推断正确的是
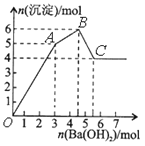
氢氧化物 | 溶液pH | |
开始沉淀 | 沉淀完全 | |
Fe(OH)3 | 2.3 | 3.4 |
Al(OH)3 | 3.3 | 5.2 |
A. OA段产生的沉淀为BaSO4和Fe(OH)3
B. 据图计算原溶液中c(Cl-)=c(SO42-)
C. AB段可能发生的反应是:2SO42-+ 2Ba2++ Al3++3OH-=2BaSO4↓+Al(OH)3↓
D. C点溶液呈碱性是因为AlO2-水解,离子方程式为:AlO2-+2H2O=Al(OH)3+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验方案能达到实验目的的是( )
编号 | A | B | C | D |
实验方案 |
|
|
|
|
实验目的 | 实验室制备乙酸乙酯 | 分离乙酸和水 | 验证溴乙烷在氢氧化钠乙醇溶液中发生消去反应产生的乙烯 | 收集乙烯并验证它与溴水发生加成反应 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com