
【题目】下列离子方程式正确的是
A. 用碳酸氢钠溶液检验水杨酸中的羧基: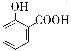 +2HCO3-→
+2HCO3-→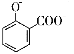 +2H2O+2CO2↑
+2H2O+2CO2↑
B. 在NaHCO3溶液中加入过量Ba(OH)2溶液:HCO3—+Ba2++OH—= BaCO3↓+H2O
C. 向Mg(HCO3)2溶液中加入过量NaOH溶液,产生白色沉淀:Mg2++2HCO3-+2OH- = MgCO3↓+2H2O
D. 用高锰酸钾溶液滴定草酸:2MnO4-+16H++5C2O42- = 2Mn2++10CO2↑+8H2O
科目:高中化学 来源: 题型:
【题目】室温下,将 4 mol A 气体和 2 mol B 气体在 2 L 的密闭容器中混合并在一定条件下发生如下反应:2A(g)+B(g)![]() XC(g),经 2 s后反应达平衡,测得 C 的浓度为 0.6 mol·L-1 ,B的物质的量为1.4 mol,现有下列几种说法:
XC(g),经 2 s后反应达平衡,测得 C 的浓度为 0.6 mol·L-1 ,B的物质的量为1.4 mol,现有下列几种说法:
①用物质 A 表示的反应的平均速率为 0.3 mol/(L·s)
②反应前容器内的压强与平衡后容器内的压强之比为1:1
③ 2 s 时物质A的转化率为30% ④ X="2"
其中正确的是
A. ①③④B. ①④C. ②③D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法中正确的有:
A. 2.4g金属镁与足量盐酸反应,转移电子的数目为0.1NA ;
B. 1L1mol/L的CaCl2溶液中含Cl-的数目为NA;
C. 在25℃、1.01×105Pa的条件下,2.24L H2中含有的分子数小于0.1NA;
D. 22 g CO2与标准状况下11.2 L H2O含有相同分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。有人模拟用CO和H2合成甲醇,其反应为:CO(g) + 2H2(g) CH3OH(g) △H<0
(1)在容积固定为1L的密闭容器内充入2 mol CO和4 mol H2发生上述反应,20min时用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.4 | 10.2 | 8.4 | 7.0 | 6.2 | 6.2 |
则反应从开始到20min时,以CO浓度变化表示的平均反应速率v(CO)=_________mol/(L·min),该温度下平衡常数K=___________,若平衡后增大压强,则K值_________(填“增大”、“减小”或“不变”)。
(2)在恒温恒容的密闭容器中,不能判定CO(g)+2H2(g) CH3OH(g) △H<0,反应达到平衡的是___________;
A、压强保持不变 B、气体的密度保持不变
C、气体平均摩尔质量保持不变 D、速率v(H2):v(CH3OH)=2:1
(3)如图是甲醇燃料电池结构示意图,C是________(填“正”或“负”)极,写出此电极的电极反应式__________________________________________。

(4)若以该电池为电源,用石墨做电极电解100mL CuSO4溶液,电解一段时间后,两极均收集到11.2L的气体(标准状况下),则原CuSO4溶液的物质的量浓度为________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)NOx和SO2在空气中存在下列平衡:
2NO(g)+ O2(g) 2NO2(g) △H= -112 kJ·mol-1,
2SO2(g)+ O2 (g) 2SO3(g) △H= -196 kJ·mol-1;
SO2通常在NO2的存在下,进一步被氧化,生成SO3。写出NO2和SO2反应的热化学方程式为________________________________。
(2)烟气中的SO2可以用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)

①图中a极要连接电源的_______(填“正”或“负”)极,C口流出的物质是_______。
②SO32-放电的电极反应式为_____________________________________。
(3)常温下,烟气中SO2被NaOH溶液吸收可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是_____________________________________(写出主要反应的离子方程式),该溶液中c(Na+)_________ 2c(SO32-)+ c(HSO3-)(填“>”“<”或“=”);
②常温下,0.1mol/L的NaHSO3溶液的pH=6,则c(SO32-)- c(H2SO3)= _________ mol/L(填写准确数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁铝合金溶于100mL稀硝酸中,产生1.12LNO气体(标准状况),向反应后的溶液中加入NaOH溶液,产生沉淀情况如图所示。下列说法不正确的是

A. 原溶液中c(HNO3)=2.6mol/L B. 沉淀最大质量为4.08g
C. m(Mg):m(Al)=8:9 D. 氢氧化钠溶液浓度为3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 某些花岗石产生氡(22288Rn),该元素的相对原子质量为222
B. Se是人体必需的微量元素, 7834Se和8034Se互为同位素
C. F2通入氯化钠溶液中,生成的主要气体为O2
D. 136CNMR(核磁共振)可用于含碳化合物的结构分析,![]() C的中子数为7
C的中子数为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种元素是短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W是该元素所在周期原子半径最大的元素,W原子的质子数等于Y、Z原子的最外层电子数之和。Y与X形成的分子中有3个共价键,该分子中含有10个电子。Z原子最外层电子数是次外层电子数的3倍,试判断:
(1)X、Z两种元素的元素符号为X________,Z________。
(2)由以上元素两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为________________。
(3)①由X、Y、Z所形成的常见离子化合物是__________________(写化学式)。
②该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为___________。
③化合物WY3的晶体结构中含有的化学键为________(选填序号)。
A.只含离子键 B.只含共价键 C.既含离子键又含共价键
④X与W形成的化合物与水反应时,水作________(填“氧化剂”或“还原剂”)。
(4)用电子式表示化合物W2Z的形成过程:_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com