
【题目】将镁铝合金溶于100mL稀硝酸中,产生1.12LNO气体(标准状况),向反应后的溶液中加入NaOH溶液,产生沉淀情况如图所示。下列说法不正确的是

A. 原溶液中c(HNO3)=2.6mol/L B. 沉淀最大质量为4.08g
C. m(Mg):m(Al)=8:9 D. 氢氧化钠溶液浓度为3mol/L
【答案】A
【解析】
向反应溶液中加入NaOH溶液,开始没有沉淀,说明硝酸过量,与硝酸反应的NaOH溶液是10mL,从开始沉淀到沉淀达到最大时消耗NaOH溶液是50mL,溶解氢氧化铝消耗NaOH溶液是10mL,则生成氢氧化铝消耗NaOH溶液是30mL,所以生成氢氧化镁消耗的NaOH溶液20mL。1.12LNO气体(标准状况)的物质的量为1.22L÷22.4L/mol=0.05mol,则转移的电子总数为n(e-)=0.15mol,设镁铝合金中镁的物质的量为xmol,铝的物质的量为ymol,根据得失电子守恒得2x+3y=0.15,根据生成氢氧化铝消耗NaOH溶液是30mL,生成氢氧化镁消耗的NaOH溶液20mL,根据方程式对应关系Al3++3OH-=Al(OH)3![]() ,Mg2++2OH-=Mg(OH)2
,Mg2++2OH-=Mg(OH)2![]() 可得x=y,两式结合解得x=y=0.03mol;根据溶解氢氧化铝消耗NaOH溶液是10mL,由Al(OH)3+OH-=2H2O+AlO2-可知氢氧化钠的物质的量浓度为0.03mol÷0.01L=3mol/L。
可得x=y,两式结合解得x=y=0.03mol;根据溶解氢氧化铝消耗NaOH溶液是10mL,由Al(OH)3+OH-=2H2O+AlO2-可知氢氧化钠的物质的量浓度为0.03mol÷0.01L=3mol/L。
A、可根据沉淀达到最大时所得溶液是硝酸钠,根据钠离子守恒与硝酸根守恒可知硝酸的物质的量为n(HNO3)=n(NO)+2n(Mg2+)+3n(Al3+)+3mol/L×10mL=0.05mol+0.06mol+0.09mol+0.03mol=0.23mol,所以 原溶液中c(HNO3)=n/V=2.3mol÷0.1L=2.3mol/L,故A符合题意;
B、根据上述分析可知,沉淀最大时为氢氧化镁和氢氧化铝,质量为n(Mg(OH)2)×M(Mg(OH)2)+n(Al(OH)3)×M(Al(OH)3)=4.08g,故B不符合题意;
C、根据上述分析可知,镁和铝的物质的量均为0.03mol,则质量之比为摩尔质量之比24:27=8:9,故C不符合题意;
D、根据上述分析可知,氢氧化钠溶液浓度为3mol/L,故D不符合题意;
综上所述,本题应选A。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.2p2表示2p能级有两个轨道
B.在CS2分子中α键与π键的数目之比是2︰1
C.电子仅在激发态跃进到基态时才会产生原子光谱
D.表示一个某原子在第三电子层上有10个电子可以写3s23p63d2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图:
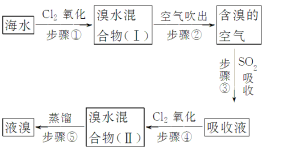
(1)步骤①反应的离子方程式是_____________________________。
(2)步骤③反应的化学方程式是______________________________。
(3)从理论上考虑,下列也能吸收Br2的是________。
A.NaOH B.FeCl2 C.Na2SO3 D.H2O
(4)步骤⑤蒸馏的过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 用碳酸氢钠溶液检验水杨酸中的羧基: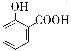 +2HCO3-→
+2HCO3-→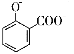 +2H2O+2CO2↑
+2H2O+2CO2↑
B. 在NaHCO3溶液中加入过量Ba(OH)2溶液:HCO3—+Ba2++OH—= BaCO3↓+H2O
C. 向Mg(HCO3)2溶液中加入过量NaOH溶液,产生白色沉淀:Mg2++2HCO3-+2OH- = MgCO3↓+2H2O
D. 用高锰酸钾溶液滴定草酸:2MnO4-+16H++5C2O42- = 2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下某溶液中由水电离产生的c(H+)等于10-10mol·L-1,该溶液的溶质不可能是( )
A.NaHSO4B.NaClC.HClD.Ba(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
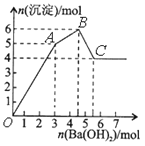
【题目】向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成的pH列于下表(已知:偏铝酸钡易溶于水)。以下推断正确的是
氢氧化物 | 溶液pH | |
开始沉淀 | 沉淀完全 | |
Fe(OH)3 | 2.3 | 3.4 |
Al(OH)3 | 3.3 | 5.2 |
A. OA段产生的沉淀为BaSO4和Fe(OH)3
B. 据图计算原溶液中c(Cl-)=c(SO42-)
C. AB段可能发生的反应是:2SO42-+ 2Ba2++ Al3++3OH-=2BaSO4↓+Al(OH)3↓
D. C点溶液呈碱性是因为AlO2-水解,离子方程式为:AlO2-+2H2O=Al(OH)3+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的内部各能层均排满,且最外层有一个电子;D与E同周期,价电子数为2。则:
(1)写出基态E原子的价电子排布式___________。
(2)A的单质分子中π键的个数为________。
(3)A、B、C三种元素第一电离能由大到小的顺序为_______(用元素符号表示)
(4)B元素的氢化物的沸点是同族元素中最高的,原因是_______。
(5)A的最简单氢化物分子的空间构型为_____,其中A原子的杂化类型是__。
(6)C和D形成的化合物的晶胞结构如图,已知晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,求晶胞边长a=__________ pm. (用ρ、NA,C和D化合物的摩尔质量为M g.mol-1的计算式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂空气电池放电时的工作原理如图所示。下列叙述正确的是( )

A. 放电时Li+由B极向A极移动
B. 电池放电反应为4Li+O2+2H2O===4LiOH
C. B电极反应式为O2+4H++4e-===2H2O
D. 电解液a可以为氯化锂溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W 在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍。下列说法不正确的是
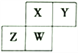
A. 原子半径:Z>W>X>Y
B. 最简单气态氢化物的热稳定性:X>Y>W>Z
C. 最高价氧化物对应水化物的酸性;X>W>Z
D. Y 与X、Y 与Z形成的化合物的化学键类型相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com