
【题目】室温下某溶液中由水电离产生的c(H+)等于10-10mol·L-1,该溶液的溶质不可能是( )
A.NaHSO4B.NaClC.HClD.Ba(OH)2
科目:高中化学 来源: 题型:
【题目】下列有关氯元素及其化合物的表示正确的是
A. 质子数为17、中子数为20的氯原子:2017ClB. 次氯酸的结构式:H-Cl-O
C. 氯分子的电子式:![]() D. 氯乙烯分子的结构简式:H3C—CH2Cl
D. 氯乙烯分子的结构简式:H3C—CH2Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定能在下列溶液中大量共存的离子组是( )
A. 水电离产生的H+浓度为1×10-12 mol·L-1的溶液:Na+、Fe2+、Cl-、NO3-
B. 能使pH试纸变深蓝色的溶液:Na+、AlO、S2-、CO![]()
C. 含有大量Fe3+的溶液:SCN-、I-、K+、Br-
D. 加入活泼金属Al能产生H2的溶液:K+、NH、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。有人模拟用CO和H2合成甲醇,其反应为:CO(g) + 2H2(g) CH3OH(g) △H<0
(1)在容积固定为1L的密闭容器内充入2 mol CO和4 mol H2发生上述反应,20min时用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.4 | 10.2 | 8.4 | 7.0 | 6.2 | 6.2 |
则反应从开始到20min时,以CO浓度变化表示的平均反应速率v(CO)=_________mol/(L·min),该温度下平衡常数K=___________,若平衡后增大压强,则K值_________(填“增大”、“减小”或“不变”)。
(2)在恒温恒容的密闭容器中,不能判定CO(g)+2H2(g) CH3OH(g) △H<0,反应达到平衡的是___________;
A、压强保持不变 B、气体的密度保持不变
C、气体平均摩尔质量保持不变 D、速率v(H2):v(CH3OH)=2:1
(3)如图是甲醇燃料电池结构示意图,C是________(填“正”或“负”)极,写出此电极的电极反应式__________________________________________。

(4)若以该电池为电源,用石墨做电极电解100mL CuSO4溶液,电解一段时间后,两极均收集到11.2L的气体(标准状况下),则原CuSO4溶液的物质的量浓度为________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+4OH- = Fe3O4↓+S4O62-+2H2O。下列说法不正确的是
A. 参加反应的氧化剂与还原剂的物质的量之比为1∶5
B. 若有2 mol Fe2+被氧化,则被Fe2+还原的O2的物质的量为0.5 mol
C. 每生成1 mol Fe3O4,反应转移的电子为4 mol
D. O2是氧化剂,S2O32-与Fe2+是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁铝合金溶于100mL稀硝酸中,产生1.12LNO气体(标准状况),向反应后的溶液中加入NaOH溶液,产生沉淀情况如图所示。下列说法不正确的是

A. 原溶液中c(HNO3)=2.6mol/L B. 沉淀最大质量为4.08g
C. m(Mg):m(Al)=8:9 D. 氢氧化钠溶液浓度为3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种,现将6.9 g样品溶于足量水中,得到澄清溶液,若再加入过量的CaCl2溶液,得到5.05g沉淀,对样品所含杂质的正确判断是
A. 肯定有Na2CO3,没有Ba(NO3)2 ,可能有有KNO3
B. 肯定有KNO3,没有Ba(NO3)2,可能还有Na2CO3
C. 肯定没有Na2CO3和Ba(NO3)2,可能有KNO3
D. 以上判断都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列叙述正确的是
A. 标准状况下,11.2 L的SO3中含有的电子数为20NA
B. 88g CO2和N2O组成的混合气体中所有的原子数为6NA
C. 2mol NO和 1mol O2充分反应后所得气体分子数为2NA
D. 常温下,1L 0.1molL-1的 Na2S 的溶液中,阴离子的总数小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有关研究需要得到反应C3H8(g)===3C(石墨,s)+4H2(g)的ΔH,但测定实验难进行。设计下图可计算得到:

①ΔH______0(填“>”、“<”或“=”)。
②ΔH=____________________(用图中其他反应的反应热表示)。
(2)已知在压强为a MPa、500℃下,2 mol H2和1 mol CO2在某密闭容器中反应,生成水和气态二甲醚CH3OCH3 。其中CO2的转化率为60%,此过程中放出0.3Q kJ热量。此反应的热化学方程式为_____________。
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/(kJ·mol-1) | 198 | 360 | 498 | x |
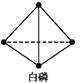
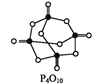
已知,白磷在空气中燃烧生成P4O10,白磷的燃烧热为2 982 kJ·mol-1,白磷(P4)、P4O10结构如图所示,则上表中x=____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com