
【题目】海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图:
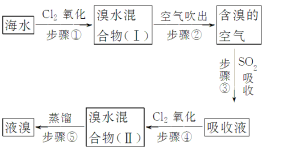
(1)步骤①反应的离子方程式是_____________________________。
(2)步骤③反应的化学方程式是______________________________。
(3)从理论上考虑,下列也能吸收Br2的是________。
A.NaOH B.FeCl2 C.Na2SO3 D.H2O
(4)步骤⑤蒸馏的过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因:______________________。
【答案】2Br- + Cl2 ═ Br2 + 2Cl-SO2 + Br2 + H2O ═ 2HBr + H2SO4A B C温度过高,大量水蒸汽随溴排出,溴气中水增加,温度过低,溴不能完全蒸出,回收率低
【解析】
海水中通入氯气氧化溴离子得到溴水的混合溶液,用热空气吹出溴单质得到含溴的空气,通过二氧化硫吸收后富集溴元素得到吸收液,再通入氯气氧化溴化氢得到溴水的混合溶液,蒸馏得到溴单质,据此分析。
(1)海水中的溴离子容易被氯气氧化为溴的单质,氧化性氯气比溴强,步骤①反应的离子方程式为:2Br-+Cl2═Br2+2Cl-;
因此,本题正确答案是:2Br-+Cl2═Br2+2Cl-;
(2)溴单质有氧化性,二氧化硫具有还原性,溴和二氧化硫在水溶液中易发生氧化还原反应,步骤③反应的化学方程式为SO2+Br2+2H2O═H2SO4+2HBr,
因此,本题正确答案是:SO2+Br2+2H2O═H2SO4+2HBr;
(3)A.NaOH溶液和溴单质反应生成溴化钠、次溴酸钠和水,可以吸收,故A正确;
B.FeCl2溶液具有还原性,可以被溴单质氧化为氯化铁,可以吸收溴单质,故B正确;
C.Na2SO3溶液具有还原性,可以被溴单质氧化,能吸收溴单质,故C正确;
D.H2O和溴单质反应微弱,不能充分吸收溴单质,故D错误;
因此,本题正确答案是:ABC;
(4)溴的沸点是58.5°C,温度应控制在80~90℃最佳,温度控制过高,水会沸腾,溴蒸气中有水,温度过低,溴蒸气不易挥发,
因此,本题正确答案是:温度过高,大量水蒸汽随溴排出,溴气中水增加,温度过低,溴不能完全蒸出,回收率低。


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
【题目】北京奥运会火炬是以中国传统祥云符号和纸卷轴为创意,由铝合金制成,使用的燃料为丙烷。下列说法不正确的是
A.丙烷完全燃烧的产物是二氧化碳和水
B.火炬燃料用丙烷比用煤油更环保
C.铝柄有一层致密的氧化膜可防止其腐蚀
D.丙烷的燃烧是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,800 ℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是

A. 发生的反应可表示为2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
B. 前2 min A的分解速率为0.1 mol/(L·min)
C. 开始时,正、逆反应同时开始
D. 2 min时,A、B、C的浓度之比为2∶3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定能在下列溶液中大量共存的离子组是( )
A. 水电离产生的H+浓度为1×10-12 mol·L-1的溶液:Na+、Fe2+、Cl-、NO3-
B. 能使pH试纸变深蓝色的溶液:Na+、AlO、S2-、CO![]()
C. 含有大量Fe3+的溶液:SCN-、I-、K+、Br-
D. 加入活泼金属Al能产生H2的溶液:K+、NH、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法中正确的有:
A. 2.4g金属镁与足量盐酸反应,转移电子的数目为0.1NA ;
B. 1L1mol/L的CaCl2溶液中含Cl-的数目为NA;
C. 在25℃、1.01×105Pa的条件下,2.24L H2中含有的分子数小于0.1NA;
D. 22 g CO2与标准状况下11.2 L H2O含有相同分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。有人模拟用CO和H2合成甲醇,其反应为:CO(g) + 2H2(g) CH3OH(g) △H<0
(1)在容积固定为1L的密闭容器内充入2 mol CO和4 mol H2发生上述反应,20min时用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.4 | 10.2 | 8.4 | 7.0 | 6.2 | 6.2 |
则反应从开始到20min时,以CO浓度变化表示的平均反应速率v(CO)=_________mol/(L·min),该温度下平衡常数K=___________,若平衡后增大压强,则K值_________(填“增大”、“减小”或“不变”)。
(2)在恒温恒容的密闭容器中,不能判定CO(g)+2H2(g) CH3OH(g) △H<0,反应达到平衡的是___________;
A、压强保持不变 B、气体的密度保持不变
C、气体平均摩尔质量保持不变 D、速率v(H2):v(CH3OH)=2:1
(3)如图是甲醇燃料电池结构示意图,C是________(填“正”或“负”)极,写出此电极的电极反应式__________________________________________。

(4)若以该电池为电源,用石墨做电极电解100mL CuSO4溶液,电解一段时间后,两极均收集到11.2L的气体(标准状况下),则原CuSO4溶液的物质的量浓度为________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁铝合金溶于100mL稀硝酸中,产生1.12LNO气体(标准状况),向反应后的溶液中加入NaOH溶液,产生沉淀情况如图所示。下列说法不正确的是

A. 原溶液中c(HNO3)=2.6mol/L B. 沉淀最大质量为4.08g
C. m(Mg):m(Al)=8:9 D. 氢氧化钠溶液浓度为3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y 能用于高性能光学树脂的合成,可由化合物X与2 甲基丙烯酰氯在一定条件下反应制得:

下列有关化合物X、Y 的说法正确的是
A. X 分子中所有原子一定在同一平面上 B. Y与Br2的加成产物分子中含有手性碳原子
C. X、Y均不能使酸性KMnO4溶液褪色 D. X→Y的反应为加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com