
| A、元素X、M可形成既含离子键又含共价键的化合物 |
| B、气态氢化物的稳定性:Z<W |
| C、Y元素在自然界中以化合物的形式存在 |
| D、W元素的含氧酸都属于强酸 |


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
| A、用硅制造集成电路、晶体管等半导体器件 | ||||
| B、在野外,用硅、石灰、烧碱的混合物制取氢气:Si+Ca (OH)2+2NaOH=Na2SiO3+CaO+2H2↑ | ||||
| C、用HF酸刻蚀玻璃:SiO2+4HF=SiF4↑+2H2O | ||||
D、单质硅的制备:SiO2+2C
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.6 g Fe和足量的盐酸完全反应失去电子数为0.3 NA |
| B、22.4L SO2含有NA个SO2分子 |
| C、1.6g CH4所含的电子数为NA |
| D、标况下,4.48L的水中含有H2O分子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Al3+、NO3-、SO42- |
| B、K+、Na+、Cl-、HCO3- |
| C、K+、Na+、Cl-、S2- |
| D、K+、NH4+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢硫酸是一种二元弱酸:H2S?S2-+2H+ |
| B、工业用FeCl3溶液腐蚀铜线铝板:2Fe3-+Cu?2Fe2++Cu2+ |
| C、Al溶于NaOH溶液:2Al+2OH-=2AlO2-+H2↑ |
| D、用食醋除去水壶中的水后:2H++CaCO3=Ca2-+H2O+CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 无机化合物可根据其组成和性质进行分类:
无机化合物可根据其组成和性质进行分类:| 物质类别 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 | ①HCl ② | ③ ④Ba(OH)2 | ⑤Na2CO3 ⑥ | ⑦CO2 ⑧Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
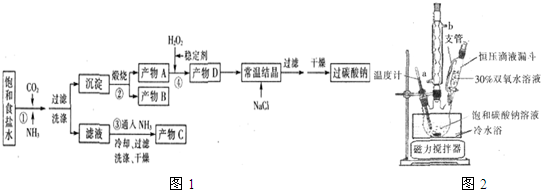
| T/℃ | 活性氧百分含量 | 产率 |
| 5~10 | 13.94 | 85.49 |
| 10~15 | 14.02 | 85.78 |
| 15~20 | 15.05 | 88.38 |
| 20~25 | 14.46 | 83.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com