
| T/℃ | 活性氧百分含量 | 产率 |
| 5~10 | 13.94 | 85.49 |
| 10~15 | 14.02 | 85.78 |
| 15~20 | 15.05 | 88.38 |
| 20~25 | 14.46 | 83.01 |


科目:高中化学 来源: 题型:
| A、物质发生化学反应时一定都伴随着能量变化 |
| B、断开化学键的过程会放出能量 |
| C、加热才能发生的反应一定是吸热反应 |
| D、等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素X、M可形成既含离子键又含共价键的化合物 |
| B、气态氢化物的稳定性:Z<W |
| C、Y元素在自然界中以化合物的形式存在 |
| D、W元素的含氧酸都属于强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分散质微粒都能透过滤纸 |
| B、都有丁达尔现象 |
| C、加入盐酸后,都先产生沉淀,然后沉淀又溶解 |
| D、都有电泳现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
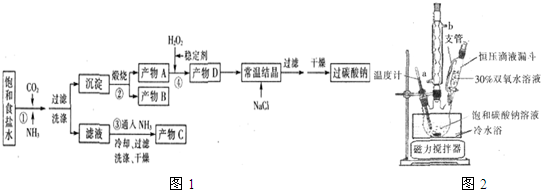
科目:高中化学 来源: 题型:
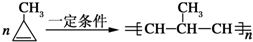 ;
; .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
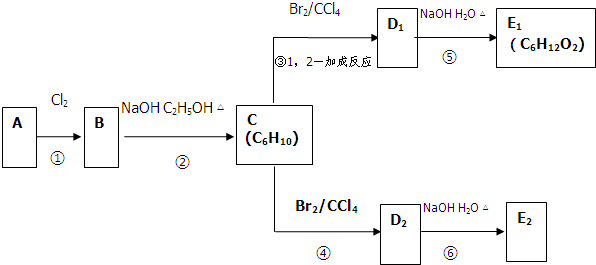
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com