
ЁОЬтФПЁПЯТЭМЪЧВПЗжЖЬжмЦкдЊЫиЕФГЃМћЛЏКЯМлгыдзгађЪ§ЕФЙиЯЕЃК
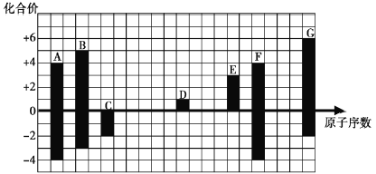
(1)дЊЫиAдкжмЦкБэжаЕФЮЛжУЮЊ________________________ЁЃ
(2)гУЕчзгЪНБэЪОD2GЕФаЮЪНЙ§ГЬЃК_________________________________________________ЃЌЦфЫљКЌЛЏбЇМќРраЭЮЊ__________ЁЃ
(3)C2ЃЁЂDЃЋЁЂG2ЃАыОЖгЩДѓЕНаЁЕФЫГађЪЧ________(ЬюРызгЗћКХ)ЁЃ
(4)CЁЂGЕФМђЕЅЧтЛЏЮяжаЃЌЗаЕуНЯЕЭЕФЪЧ________(ЬюЛЏбЇЪН)ЃЌдвђЪЧ________________ЁЃСНжжЦјЬЌЧтЛЏЮяЕФЮШЖЈадC________G(ЬюЁА>ЁБЛђЁА<ЁБ)ЁЃ
(5)CгыDаЮГЩЕФОпгаЧПбѕЛЏадЁЂПЩвдзіЙЉбѕМСЕФЛЏКЯЮяЕФЕчзгЪНЮЊ_________________ЁЃ
ЁОД№АИЁПЕк2жмЦкЂєAзх ![]() РызгМќ S2Ѓ>O2Ѓ>NaЃЋ H2S ЫЎЗжзгМфДцдкЧтМќ >
РызгМќ S2Ѓ>O2Ѓ>NaЃЋ H2S ЫЎЗжзгМфДцдкЧтМќ > ![]()
ЁОНтЮіЁП
ИљОнЭМПЩжЊЃЌAдЊЫиЕФжївЊЛЏКЯМлЪЧ+4МлКЭ-4МлЃЌЖјCдЊЫиУЛгае§МлЃЌжївЊЛЏКЯМлЪЧ-2МлЃЌЫљвдCЪЧбѕдЊЫиЃЌдђAЪЧЬМдЊЫиЃЌBЪЧЕЊдЊЫиЃЌDЕФжївЊЛЏКЯМлЪЧ+1МлЃЌDЪЧNaдЊЫиЃЌEЕФжївЊЛЏКЯМлЪЧ+3МлЃЌEЪЧТСдЊЫиЃЌFЕФжївЊЛЏКЯМлЪЧ+4МлЃЌдђFЪЧЙшдЊЫиЁЃGдЊЫиЕФжївЊЛЏКЯМлЪЧ-2МлКЭ+6МлЃЌдђGЪЧСђдЊЫиЁЃ
(1)дЊЫиAЪЧЬМдЊЫиЃЌдкжмЦкБэжаЕФЮЛжУЮЊЕк2жмЦкЂєAзх ЃЌ
ЙЪД№АИЮЊЃКЕк2жмЦкЂєAзх ЃЛ
(2)DЪЧNaдЊЫиЃЌGЪЧСђдЊЫиЃЌD2GЪЧСђЛЏФЦЪЧРызгЛЏКЯЮяЃЌЦфаЮГЩЙ§ГЬЮЊ![]() ЃЌ
ЃЌ
ЙЪД№АИЮЊЃК![]() ЃЛ
ЃЛ
(3)C2ЃЁЂDЃЋЁЂG2ЃаЮГЩЕФРызгЗжБ№ЪЧO2ЃЃЌNaЃЋЃЌS2ЃЃЌO2ЃЃЌNaЃЋЃЌЕчзгВуНсЙЙЯрЭЌЃЌдзгађЪ§дНаЁЖдгІЕФРызгАыОЖдНДѓЃЌS2ЃЃЌO2ЃзюЭтВуЕчзгЪ§ЯрЕШЃЌЕчзгВуЪ§дНЖрАыОЖдНДѓЃЌАыОЖДѓЕНаЁЕФЫГађЪЧS2Ѓ>O2Ѓ>NaЃЋЃЌ
ЙЪД№АИЮЊЃКS2Ѓ>O2Ѓ>NaЃЋЃЛ
(4)CЁЂGЕФМђЕЅЧтЛЏЮяЪЧH2OЃЌH2SЃЌЗаЕуНЯЕЭЕФЪЧH2SЃЌвђЮЊЫЎЗжзгМфДцдкЧтМќЃЌЭЌвЛжїзхДгЩЯЕНЯТЗЧН№Ъєадж№НЅМѕШѕЃЌаЮГЩЕФЦјЬЌЧтЛЏЮяЮШЖЈадж№НЅМѕШѕЃЌСНжжЦјЬЌЧтЛЏЮяЕФЮШЖЈадC>GЃЌ
ЙЪД№АИЮЊЃКH2SЃЛЫЎЗжзгМфДцдкЧтМќЃЛ>ЃЛ
(5)CгыDаЮГЩЕФОпгаЧПбѕЛЏадЁЂПЩвдзіЙЉбѕМСЕФЛЏКЯЮяЕФЕчзгЪНЮЊ![]() ЃЌ
ЃЌ
ЙЪД№АИЮЊЃК![]() ЁЃ
ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁППЇЗШїЗЫсОпгаНЯЙуЗКЕФПЙОњзїгУЃЌЦфНсЙЙМђЪНШчЯТЭМЫљЪОЃК

ЙигкПЇЗШїЗЫсЕФЯТСаа№Ъіе§ШЗЕФЪЧ(ЁЁЁЁ)
AЃЎЗжзгЪНЮЊC16H13O9
BЃЎ1 molПЇЗШїЗЫсПЩгыКЌ8 mol NaOHЕФШмвКЗДгІ
CЃЎФмЪЙЫсадKMnO4ШмвКЭЪЩЋЃЌЫЕУїЗжзгНсЙЙжаКЌгаЬМЬМЫЋМќ
DЃЎгыХЈфхЫЎФмЗЂЩњСНжжРраЭЕФЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЩшNAЮЊАЂЗќМгЕТТоГЃЪ§ЕФжЕЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.БъзМзДПіЯТЃЌ2.24LБНжаКЌC-HЪ§ФПЮЊ0.6 NA
B.ГЃЮТЯТЃЌ9.2gNO2КЭN2O4ЕФЛьКЯЦјЬхжаКЌгаЕФЕЊдзгЪ§ФПЮЊ0.2NA
C.ГЃЮТЯТЃЌ1.0LpH=13ЕФNaOHШмвКжаЃЌгЩЫЎЕчРыЕФOH-РызгЪ§ФПЮЊ0.1NA
D.дкЗДгІKClO3+6HCl=KCl+3Cl2Ёќ+3H2OжаЃЌУПЩњГЩ3molCl2зЊвЦЕФЕчзгЪ§ЮЊ6NA
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаШШЛЏбЇЗНГЬЪНЃЌе§ШЗЕФЪЧ
A.вбжЊжаКЭШШЮЊ57.3 kJ/molЃКCH3COOH(aq)ЃЋNaOH(aq)ЃНCH3COONa(aq)ЃЋH2O(l) ІЄHЃНЃ57.3 kJ/mol
B.1 mol SO2гы2 mol O2дкФГУмБеШнЦїжаЗДгІЗХГі88 kJШШСПЃЌдђЗДгІЕФШШЛЏбЇЗНГЬЪНЮЊЃК2SO2(g)ЃЋO2(g)![]() 2SO3(g) ЁїHЃНЃ176 kJ/mol
2SO3(g) ЁїHЃНЃ176 kJ/mol
C.МзЭщЕФШМЩеШШЮЊ890.3kJЁЄmolЃ1ЃЌдђМзЭщШМЩеЕФШШЛЏбЇЗНГЬЪНПЩБэЪОЮЊЃКCH4(g)ЃЋ2O2(g)ЃНCO2(g)ЃЋ2H2O(g) ІЄHЃНЃ890.3 kJЁЄmolЃ1
D.8 g ЙЬЬхСђЭъШЋШМЩеЩњГЩSO2ЃЌЗХГі74kJШШСПЃКS(s)ЃЋO2(g)ЃНSO2(g) ІЄHЃНЃ296 kJ/mol
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛЖЈЮТЖШЯТЃЌФГКуШнШнЦїФкЕФПЩФцЗДгІA(Цј)ЃЋ3B(Цј)![]() 2C(Цј)ЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
2C(Цј)ЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
A.ЕБЗДгІНјааЕНЛьКЯЦјЬхУмЖШВЛБфЪБЃЌДяЛЏбЇЦНКтзДЬЌ
B.ЕБBЕФЩњГЩЫйТЪЪЧAЕФЯћКФЫйТЪЕФ3БЖЪБЃЌЗДгІДяЛЏбЇЦНКтзДЬЌ
C.ЯђШнЦїФкГфШыКЄЦјжТЪЙбЙЧПдіДѓЃЌЛЏбЇЗДгІЫйТЪМгПь
D.ЕБЗДгІДяЦНКтКѓЃЌШєИФБфФГвЛЭтНчЬѕМўв§Ц№ЫйТЪЗЂЩњБфЛЏЃЌЦНКтвЛЖЈЛсЗЂЩњвЦЖЏ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСажИЖЈЗДгІЕФЛЏбЇгУгяБэДяе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ
A | Mg(HCO3)2ШмвКгызуСПЕФNaOHШмвКЗДгІ | Mg2ЃЋЃЋ2HCO |
B | Й§СПSO2ЭЈШыЕНNaClOШмвКжаЃК | SO2ЃЋH2OЃЋClOЃ===HClOЃЋ |
C | ЯђAl2(SO4)3ШмвКжаМгШыЙ§СПЕФЯЁАБЫЎ | Al3 ++4NH3ЁЄH2O=AlO2ЁЊ+4NH4++2H2O |
D | KClOМюадШмвКгыFeЃЈOHЃЉ3ЗДгІжЦШЁK2FeO4 | 3ClOЉ+2FeЃЈOHЃЉ3ЃН2FeO42Љ+3ClЉ+4H++H2O |
A. AB. BC. CD. D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙЄвЕЩЯВЩгУЫсадИпХЈЖШКЌЩщЗЯЫЎ(ЩщжївЊвдбЧЩщЫсH3AsO3аЮЪНДцдк)ЬсШЁжавЉвЉМСAs2O3ЁЃЙЄвеСїГЬШчЯТЃК
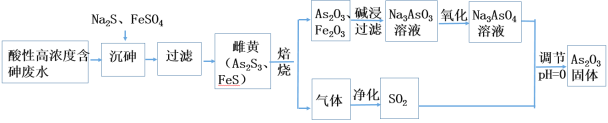
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉвбжЊЩщдЊЫигыNЭЌвЛжїзхЃЌдзгБШNдзгЖрСНИіЕчзгВуЃЌдђЩщдЊЫиЕФдзгађЪ§ЮЊ________ЃЌЁАГСЩщЁБжаЫљгУNa2SЕФЕчзгЪНЮЊ_____________ЁЃ
ЃЈ2ЃЉвбжЊЃКAs2S3гыЙ§СПЕФS2-ДцдквдЯТЗДгІЃКAs2S3(s)+3S2-(aq) ![]() 2AsS33- ЃЛЁАГСЩщЁБжаFeSO4ЕФзїгУЪЧ___________________________ЁЃ
2AsS33- ЃЛЁАГСЩщЁБжаFeSO4ЕФзїгУЪЧ___________________________ЁЃ
ЃЈ3ЃЉЁАБКЩеЁБЙ§ГЬжагЩгкЬѕМўЕФдвђЃЌЩњГЩЕФШ§бѕЛЏЖўЬњжаЛьгаЫФбѕЛЏШ§ЬњЃЌжЄУїЫФбѕЛЏШ§ЬњДцдкЕФЪдМСЪЧ_________________________________ЁЃ(аДУћГЦ)
ЃЈ4ЃЉЕїНкpH=0ЪБЃЌгЩNa3AsO4жЦБИAs2O3ЕФРызгЗНГЬЪНЮЊЃК_______________ЁЃ
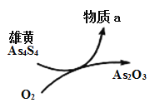
ЃЈ5ЃЉвЛЖЈЬѕМўЯТЃЌгУалЛЦ(As4S4)жЦБИAs2O3ЕФзЊЛЏЙиЯЕШчЭМЫљЪОЁЃШєЗДгІжаЃЌ1molAs4S4(ЦфжаAsдЊЫиЕФЛЏКЯМлЮЊ+2Мл)ВЮМгЗДгІЪБЃЌзЊвЦ28mole-ЃЌдђЮяжЪaЮЊ___________ЁЃ(ЬюЛЏбЇЪН)
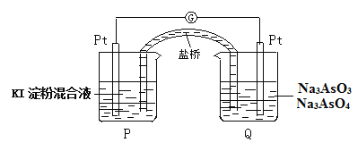
ЃЈ6ЃЉФГдЕчГизАжУШчЭМЃЌЕчГизмЗДгІЮЊЃКAsO43-+2I-+H2O![]() AsO33-+I2+2OH-ЁЃЕБPГижаШмвКгЩЮоЩЋБфГЩРЖЩЋЪБЃЌе§МЋЩЯЕФЕчМЋЗДгІЪНЮЊ____________________________ЁЃвЛЖЮЪБМфКѓЕчСїМЦжИеыВЛЗЂЩњЦЋзЊЁЃгћЪЙжИеыЦЋзЊЗНЯђгыЦ№ЪМЪБЯрЗДЃЌПЩВЩШЁЕФДыЪЉЪЧ____________(ОйвЛР§)ЁЃ
AsO33-+I2+2OH-ЁЃЕБPГижаШмвКгЩЮоЩЋБфГЩРЖЩЋЪБЃЌе§МЋЩЯЕФЕчМЋЗДгІЪНЮЊ____________________________ЁЃвЛЖЮЪБМфКѓЕчСїМЦжИеыВЛЗЂЩњЦЋзЊЁЃгћЪЙжИеыЦЋзЊЗНЯђгыЦ№ЪМЪБЯрЗДЃЌПЩВЩШЁЕФДыЪЉЪЧ____________(ОйвЛР§)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкtЁцЪБЃЌAg2CrO4(щйКьЩЋ)дкЫЎШмвКжаЕФГСЕэШмНтЦНКтЧњЯпШчЭМЫљЪОЁЃгжжЊAgClЕФKspЃН1.8ЁС10Ѓ10ЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ(ЁЁЁЁ)
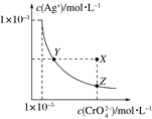
A.tЁцЪБЃЌAg2CrO4ЕФKspЮЊ1ЁС10Ѓ8
B.БЅКЭAg2CrO4ШмвКжаМгШыK2CrO4ВЛФмЪЙШмвКгЩYЕуБфЮЊXЕу
C.tЁцЪБЃЌYЕуКЭZЕуЪБAg2CrO4ЕФKspЯрЕШ
D.tЁцЪБЃЌНЋ0.01 molЁЄLЃ1AgNO3ШмвКЕЮШы20 mL 0.01 molЁЄLЃ1KClКЭ0.01 molЁЄLЃ1K2CrO4ЕФЛьКЯШмвКжаЃЌClЃЯШГСЕэ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПСђЧшЛЏМиПЩгУгкХЉвЉЁЂвНвЉЁЂЕчЖЦЁЂЛЏбЇЪдМСЁЂМьЖЈЬњРызгЁЂЭКЭвјЕШЁЃФГаЫШЄаЁзщЭЌбЇдкЪЕбщЪвФЃФтЙЄвЕжЦБИСђЧшЛЏМиЃЈKSCNЃЉЃЌЪЕбщзАжУШчЭМЫљЪОЁЃ
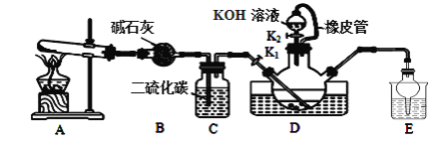
ЪЕбщВНжшШчЯТЃК
ЃЈ1ЃЉжЦБИNH4SCNШмвКЃКCS2ЃЋ2NH3![]() NH4SCNЃЋH2SЃЌИУЗДгІНјааЕФБШНЯЛКТ§ЃЌNH3ВЛШмгкCS2ЁЃ
NH4SCNЃЋH2SЃЌИУЗДгІНјааЕФБШНЯЛКТ§ЃЌNH3ВЛШмгкCS2ЁЃ
ЂйЪЕбщЧАЃЌгІНјааЕФВйзїЪЧ__ЃЛШ§ОБЩеЦПФкЪЂЗХгавЛЖЈСПЕФCS2ЁЂЫЎКЭДпЛЏМСЁЃШ§ОБЩеЦПЕФЯТВуCS2вКЬхБиаыНўУЛЕМЦјЙмПкЃЌФПЕФЪЧ__ЁЃ
ЂкЪЕбщПЊЪМЪБДђПЊK1ЃЌМгШШзАжУAЁЂDЃЌЛКТ§ЕиЯђзАжУDжаГфШыЦјЬхЁЃзАжУAжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЪЧ__ЃЌзАжУCЕФзїгУПЩФмЪЧ__ЁЃ
ЃЈ2ЃЉжЦБИKSCNШмвКЃКвЦШЅзАжУAДІЕФОЦОЋЕЦЃЌЙиБеK1ЃЌДђПЊK2ЃЌРћгУФЭМюЗжвКТЉЖЗБпМгвКБпМгШШЃЌдђДЫЪБзАжУDжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЪЧ__ЁЃ
ЃЈ3ЃЉжЦБИKSCNОЇЬхЃКЯШТЫШЅШ§ОБЩеЦПжаЕФЙЬЬхДпЛЏМСЃЌдйМѕбЙеєЗЂХЈЫѕЃЌРфШДНсОЇЃЌ___ЃЌЕУЕНСђЧшЛЏМиОЇЬхЁЃ
ЃЈ4ЃЉВтЖЈKSCNЕФКЌСПЃКГЦШЁ10.00gбљЦЗХфГЩ1000mLШмвКЃЌСПШЁ25.00mLШмвКгкзЖаЮЦПжаЃЌВЂМгШыМИЕЮFe(NO3)3ШмвКЃЌгУ0.1000molЁЄL-1AgNO3БъзМШмвКЕЮЖЈЁЃОЙ§3ДЮЦНааЪдбщЃЌДяЕНЕЮЖЈжеЕуЪБЃЌЯћКФAgNO3БъзМШмвКЕФЬхЛ§ЦНОљЮЊ20.00mLЁЃЕЮЖЈЗДгІЕФРызгЗНГЬЪНЮЊSCN-ЃЋAg+=AgSCNЁ§ЁЃ
ЂйХаЖЯДяЕНЕЮЖЈжеЕуЕФЗНЗЈЪЧ__ЁЃ
ЂкбљЦЗжаKSCNЕФжЪСПЗжЪ§ЮЊ__ЃЈKSCNЕФФІЖћжЪСПЮЊ97gЁЄmol-1ЃЌБЃСє4ЮЛгааЇЪ§зжЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com