
【题目】
(1)写出醋酸在水溶液中的电离方程式 。若某温度下,CH3COOH(aq)与NaOH(aq)反应的△H=" -" 46.8kJ·mol-1,HCl(aq)与NaOH(aq)反应的△H=" -" 55.6 kJ·mol-1,则CH3COOH在水溶液中电离的△H= kJ·mol-1。
(2)某温度下,实验测得0.1mol·L-1醋酸电离度约为1.5%,则该温度下0.1mol·L-1CH3COOH的电离平衡常数K=________(列出计算式,已知电离度![]() )
)
(3)近年来化学家研究开发出用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,不必生产乙醇或乙醛做中间体,使产品成本降低,具有明显经济优势。其合成的基本反应如下:
![]()
下列描述能说明乙烯与乙酸合成乙酸乙酯的反应已达化学平衡的是 。
A.乙烯、乙酸、乙酸乙酯的浓度相同 |
B.酯化合成反应的速率与酯分解反应的速率相等 |
C.乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol |
D.体系中乙烯的百分含量一定 |
(4)在n(乙烯)与n(乙酸)物料比为1的条件下,某研究小组在不同压强下进行了在相同时间点乙酸乙酯的产率随温度的变化的测定实验,实验结果如图所示。回答下列问题:
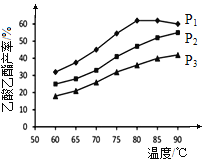
① 温度在60~80℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是 [用![]() (P1)、
(P1)、![]() (P2)、
(P2)、![]() (P3)分别表示不同压强下的反应速率],分析其原因为 。
(P3)分别表示不同压强下的反应速率],分析其原因为 。
②压强为P1MPa、温度60℃时,若乙酸乙酯的产率为30℅,则此时乙烯的转化率为 。
③在压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是_________。
④根据测定实验结果分析,较适宜的生产条件是 (填出合适的压强和温度)。为提高乙酸乙酯的合成速率和产率,可以采取的措施有 (任写出一条)。
【答案】(1)CH3COOH![]() CH3COO—+ H+(1分) +8.8(1分)
CH3COO—+ H+(1分) +8.8(1分)
(2)![]() (2分)
(2分)
(3)BD(2分)(4)①![]() (P1)﹥
(P1)﹥![]() (P2)﹥
(P2)﹥![]() (P3)(1分) 其它条件相同时,对有气体参与的反应,压强越大化学反应速率越快(1分)②30℅(2分)③由图像可知,P1MPa 、80℃时反应已达平衡且正反应放热,故压强不变升高温度平衡逆向移动产率下降(2分)
(P3)(1分) 其它条件相同时,对有气体参与的反应,压强越大化学反应速率越快(1分)②30℅(2分)③由图像可知,P1MPa 、80℃时反应已达平衡且正反应放热,故压强不变升高温度平衡逆向移动产率下降(2分)
④P1MPa、80℃(1分) 通入乙烯气体或增大压强(1分)
【解析】试题分析:(1)若某温度下,CH3COOH(aq)与NaOH(aq)反应的△H=" -" 46.8kJ·mol-1,HCl(aq)与NaOH(aq)反应的△H=" -" 55.6 kJ·mol-1,则有①CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H=" -" 46.8kJ·mol-1,②HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=" -" 55.6 kJ·mol-1,则根据盖斯定律可知①-②即得到CH3COOH在水溶液中电离的△H=+8.8kJ·mol-1。
(2)某温度下,实验测得0.1mol·L-1醋酸电离度约为1.5%,则溶液中氢离子和醋酸根离子的浓度约为0.1mol/L×1.5%=0.0015mol/L,溶液中醋酸分子的浓度为0.1mol/L-0.0015mol/L,该温度下0.1mol·L-1CH3COOH的电离平衡常数K=![]() 。
。
(3)A.乙烯、乙酸、乙酸乙酯的浓度相同但不一定不变,则不一定达到平衡状态,A;B.酯化合成反应的速率与酯分解反应的速率相等,说明反应达到平衡状态,B正确;C.乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol均表示逆反应速率相等,反应不一定达到平衡状态,C错误;D.体系中乙烯的百分含量一定说明正逆反应速率相等,反应达到平衡状态,D正确,答案选BD。
(4)①正反应是体积减小的,增大压强乙酸乙酯的产率增大,其它条件相同时,对有气体参与的反应,压强越大化学反应速率越快,所以温度在60~80℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是![]() (P1)﹥
(P1)﹥![]() (P2)﹥
(P2)﹥![]() (P3)。
(P3)。
②压强为P1MPa、温度60℃时,若乙酸乙酯的产率为30℅,则根据方程式可知此时乙烯的转化率为30%。
③由图像可知,P1MPa 、80℃时反应已达平衡且正反应放热,故压强不变升高温度平衡逆向移动产率下降。
④根据测定实验结果分析,较适宜的生产条件是P1MPa、80℃。正反应体积减小,为提高乙酸乙酯的合成速率和产率,可以采取的措施有通入乙烯气体或增大压强。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】为了配制NH![]() 的浓度与Cl-的浓度比为1∶1的溶液,可在NH4Cl溶液中加入
的浓度与Cl-的浓度比为1∶1的溶液,可在NH4Cl溶液中加入
①适量的盐酸 ②适量的NaCl ③适量的氨水④适量的NaOH
A.①② B.③ C.③④ D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能层和能级的说法正确的是
A. 3p2表示3p能级有两个轨道
B. 能层序数越大的能级能量不一定越高
C. 同一原子中,1s、2s、3s电子的能量逐渐减小
D. 同一原子中,2p、3p、4p能级的轨道数依次增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列转化关系(反应条件略):
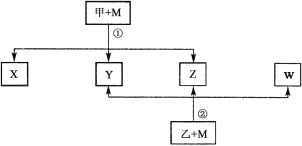
已知:① X 、Y 、Z 、W 均为氧化物。常态下,X 是红棕色气体;Y 能使澄清石灰水变浑浊但不能使品红溶液褪色。② 相对分子质量:甲﹤乙 。③ 将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。请填写下列空白:
(1)Z的化学式: 。
(2)将乙的浓溶液露置在空气中一段时间,质量增加浓度降低,反映出乙的浓溶液具有 性。利用这种性质可以进行 项(填字母)实验操作。
a.钝化铁片 b.检验Ba2+离子 c.干燥氨气 d.干燥氯气
(3)在 X 和 Z 的反应中,被氧化的X 与被还原的X 的物质的量之比是: 。
(4)W可用于工业制溴过程中吸收潮湿空气中的Br2 ,写出该反应的离子方程式: 。
(5)写出M与甲的浓溶液在加热条件下反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代著名哲学家、科学家方以智在其《物理小识》卷七《金石类》中指出:有硇水者,剪银塊投之,则旋而为水。其中的“硇水”指
A. 醋酸 B. 盐酸 C. 硝酸 D. 硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向2L恒容密闭容器中充入1mol PCl5,发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
反应过程中测定的部分数据见下表(反应过程中条件不变):
t/s | 0 | 50 | 150 | 250 | 350 | 450 | |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 | x | |
请回答下列问题:
(1) x 的值是________;
(2) 0-50s 内,用PCl3的浓度变化表示的化学反应速率是________;
(3)250s 以后,Cl2的物质的量不再改变的原因是_______________;
(4) 250s 时,容器中Cl2的物质的量是_____,PCl5的物质的量是______,PCl5的转化率是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用硫铁矿石(主要成分FeS2)在沸腾炉中焙烧,经过一系列反应,得到硫酸,焙烧后的矿渣用于炼铁。其转化过程如下图所示(部分条件、反应物和产物已略去):

请回答下列问题:
(1)在上面转化过程中,硫元素被氧化的反应是________(填反应编号)。
(2)写出反应②中炼铁的化学方程式_____________。若用1000t含杂质28%的矿渣炼铁,理论上可得到含铁96%的生铁质量为_____________ t.
(3)写出反应①的化学方程式 ,若有12.0g FeS2参加反应,则发生转移的电子数为 。
(4)烟气中SO2的排放会造成酸雨,工业上常用Na2SO3溶液来吸收SO2以减少对环境的危害。
①常温下,将SO2通入一定体积的1.0mol·L-1Na2SO3溶液中,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,此时溶液中c(SO32-)的浓度是0.2mol·L-1,则溶液中c(HSO3-)是 mol·L-1。用化学平衡原理解释此时溶液显酸性的原因 。
②向①中pH约为6时的吸收液中通入足量O2充分反应。取反应后溶液10mL与10mLBaCl2溶液混合,欲使混合时能生成沉淀,所用BaCl2溶液的浓度不得低于 mol·L-1。[已知25℃时,Ksp(BaSO3)=5.48×10-7, Ksp(BaSO4)= 1.08×10-10]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应 A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是
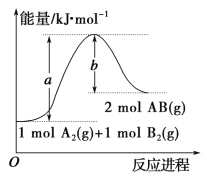
A.每生成2分子AB 吸收 b kJ 热量
B.该反应热 ΔH=+(a-b)kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂 1 mol A—A 和1 mol B—B 键,放出 a kJ 能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在以下各种情形下,下列电离方程式的书写正确的是
A.熔融状态下的NaHSO4电离:NaHSO4=Na++H++SO42-
B.H2CO3的电离:H2CO3![]() 2H++CO32-
2H++CO32-
C.Fe(OH)3的电离:Fe(OH)3![]() Fe3++3OH-
Fe3++3OH-
D.水溶液中的NaHSO4电离:NaHSO4=Na++HSO4-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com