
【题目】明代著名哲学家、科学家方以智在其《物理小识》卷七《金石类》中指出:有硇水者,剪银塊投之,则旋而为水。其中的“硇水”指
A. 醋酸 B. 盐酸 C. 硝酸 D. 硫酸
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】【2017山西模拟】下列关于化学反应及相关概念的叙述正确的是( )
A.冰和水之间的相互转化是化学变化
B.溶于水能导电的化合物一定是电解质
C.碱性氧化物一定是金属氧化物
D.有单质生成的反应一定是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,等体积、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如下图所示,下列说法正确的是( )
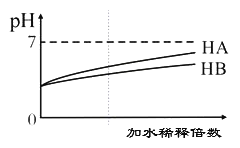
A. 向HB溶液中滴加NaOH溶液的过程中,水的电离程度一直增大
B. 用pH为11的某碱与pH为3的HB溶液等体积混合后,溶液不可能显碱性
C. 氨水与HA溶液混合后的溶液中可能存在:c(NH4+ )>c(A+)>c(H+)>c(OH-)
D. 完全中和等体积等pH的HA、HB两溶液时,消耗同浓度NaOH溶液的体积:HA<HB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应:
2 SO2(g)+ O2(g)![]() 2SO3△H<0。得到如表中的两组数据:
2SO3△H<0。得到如表中的两组数据:
实验编号 | 温度/℃ | 平衡常数/mol-1·L | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
下列说法不正确的是
A.x= 1.6,y=0.2 ,t<6
B.T1、T2的关系:T1 > T2
C.K1、K2的关系:K2>K1
D.实验1在前6min的反应速率υ(SO2)=0.2 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.直径介于1nm~100nm之间的微粒称为胶体
B.电泳现象可以证明胶体粒子带电
C.丁达尔效应是溶液与胶体的本质区别
D.胶体粒子很小,可以透过滤纸和半透膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)写出醋酸在水溶液中的电离方程式 。若某温度下,CH3COOH(aq)与NaOH(aq)反应的△H=" -" 46.8kJ·mol-1,HCl(aq)与NaOH(aq)反应的△H=" -" 55.6 kJ·mol-1,则CH3COOH在水溶液中电离的△H= kJ·mol-1。
(2)某温度下,实验测得0.1mol·L-1醋酸电离度约为1.5%,则该温度下0.1mol·L-1CH3COOH的电离平衡常数K=________(列出计算式,已知电离度![]() )
)
(3)近年来化学家研究开发出用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,不必生产乙醇或乙醛做中间体,使产品成本降低,具有明显经济优势。其合成的基本反应如下:
![]()
下列描述能说明乙烯与乙酸合成乙酸乙酯的反应已达化学平衡的是 。
A.乙烯、乙酸、乙酸乙酯的浓度相同 |
B.酯化合成反应的速率与酯分解反应的速率相等 |
C.乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol |
D.体系中乙烯的百分含量一定 |
(4)在n(乙烯)与n(乙酸)物料比为1的条件下,某研究小组在不同压强下进行了在相同时间点乙酸乙酯的产率随温度的变化的测定实验,实验结果如图所示。回答下列问题:
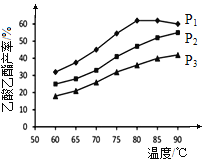
① 温度在60~80℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是 [用![]() (P1)、
(P1)、![]() (P2)、
(P2)、![]() (P3)分别表示不同压强下的反应速率],分析其原因为 。
(P3)分别表示不同压强下的反应速率],分析其原因为 。
②压强为P1MPa、温度60℃时,若乙酸乙酯的产率为30℅,则此时乙烯的转化率为 。
③在压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是_________。
④根据测定实验结果分析,较适宜的生产条件是 (填出合适的压强和温度)。为提高乙酸乙酯的合成速率和产率,可以采取的措施有 (任写出一条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A 和 2 mol B 进行如下反应:3A(g)+2B(g)![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成 1.6 mol C, 下列说法正确的是( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成 1.6 mol C, 下列说法正确的是( )
A. 该反应的化学平衡常数表达式是K=![]()
B. 此时,B 的平衡转化率是40%
C. 增大该体系的压强,化学平衡常数增大
D. 增加 B,B 的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.
①D在周期表中的位置是____ ;
②用电子式表示A、B形成化合物的过程:____ ;
③D2C的电子式为 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeC13、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
A.加入KSCN溶液一定会变红色
B.溶液中一定含Fe2+
C.溶液中一定含Cu2+
D.剩余固体中一定含Cu
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com