
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(s)+H2(g) | K3 | ? | ? |

| K2 |
| K1 |
| K2 |
| K1 |
| K2 |
| K1 |
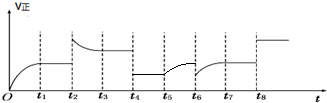 ,
, .
.


 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
| A、液氨可用作制冷剂 |
| B、小苏打用于治疗胃酸过多 |
| C、明矾可用于自来水的杀菌消毒 |
| D、硅酸钠用于制备硅胶和木材防火剂的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
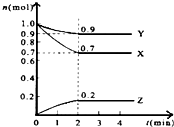 某实验小组对H2O2的分解做了如下探究:
某实验小组对H2O2的分解做了如下探究:| 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
| 无催化剂 不加热 |
几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂 加热 |
360 | 480 | t | 720 |
| MnO2催化剂 加热 |
10 | 25 | 60 | 120 |
| 催化剂 MnO2 |
操作 情况 |
观察结果 | 反应完成 所需时间 |
| 粉末状 | 混合 不振荡 |
剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)A、B两元素均位于周期表中第三周期,它们的原子核外最外层电子数之和为7,其中A元素的原子核外最外层电子数为1个,两者间可形成化合物A2B.根据以上条件回答下列问题:
(1)A、B两元素均位于周期表中第三周期,它们的原子核外最外层电子数之和为7,其中A元素的原子核外最外层电子数为1个,两者间可形成化合物A2B.根据以上条件回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、两种兴奋剂均属于芳香烃 |
| B、两种分子中的所有原子均可能共平面 |
| C、利尿酸分子中有三种含氧官能团,有六种氢原子 |
| D、1 mol兴奋剂X与足量浓溴水反应,最多消耗4 mol Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com