
【题目】实验室常利用“棕色环”现象检验NO3— 离子。其方法为:取含有 NO3— 的溶液于试管中,加入 FeSO4 溶液振荡,然后沿着试管内壁加入浓 H2SO4,在溶液的界面上岀现“棕色环”。回答下列问题:
(1)基态 Fe2+核外未成对电子个数为_____。
(2)形成“棕色环”主要发生如下反应:
3[Fe( H2O)6]2+ + NO3-+4H+ =3[Fe(H2O)6]3+ + NO ↑+2H2O
[Fe( H2O)6]2+ + NO=[Fe(NO) (H2O)5]2+(棕色)+ H2O
[Fe(NO)(H2O)5]2+中,配体是______、______,配位数为______。
(3)与 NO 互为等电子体的微粒是_____ (任写一例)。
(4)SO42-的空间构型是_____,其中 S 原子的杂化方式是________ 。
(5)铁原子在不同温度下排列构成不同晶体结构,在 912℃以下排列构成的晶体叫做α-铁; 在 912℃至 1394℃之间排列构成的晶体叫做γ -铁;在 1394℃以上排列构成的晶体, 叫做δ-铁。晶胞剖面结构如图所示:
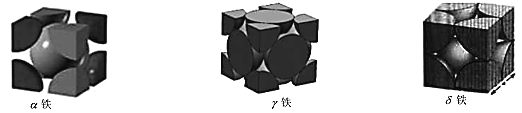
①α-铁的原子堆积方式为 _____ 。δ-铁配位数为 ____ 。
②已知γ-铁晶体密度为d g/cm3,则 Fe 原子的半径为____nm(用含 d、NA 的式子表示)。
【答案】4 NO H2O 6 O![]() 或N
或N![]() 正四面体 sp3杂化 体心立方堆积 6
正四面体 sp3杂化 体心立方堆积 6 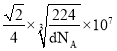
【解析】
(1)基态Fe原子核外电子排布式为[Ar]3d64s2,根据洪特规则判断;
(2)[Fe(NO)(H2O)5]2+中配体为NO、H2O,配合物中配位数等于配体的个数之和;
(3)价电子数和原子个数相等的微粒为等电子体,利用等电子原理分析解答;
(4)利用中心原子价层电子互斥理论判断杂化类型和空间结构;
(5)①根据图示,α-铁和δ-铁的铁原子堆积方式为体心立方堆积;
②晶胞棱长为acm,根据![]() ,
,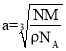 ,结合图示,面对角线是4个铁原子的半径,则铁原子半径=
,结合图示,面对角线是4个铁原子的半径,则铁原子半径=![]() 。
。
(1)基态Fe原子核外电子排布式为[Ar]3d64s2 ,基态Fe2+ 核外电子排布式为[Ar]3d6,根据洪特规则,成单电子数为4;
(2)[Fe(NO)(H2O)5]2+中配体为NO、H2O,配合物中配位数等于配体的个数之和,则配位数为5+1=6;
(3)NO为双原子价电子总数为(5+6),其等电子体可能是O![]() (6+6-1)或N
(6+6-1)或N![]() (5+5+1);
(5+5+1);
(4)SO![]() 的中心硫原子价层电子对数为4+
的中心硫原子价层电子对数为4+![]() (8-4×2)=4,S的杂化方式为sp3,空间构型是正四面体;
(8-4×2)=4,S的杂化方式为sp3,空间构型是正四面体;
(5)①α-铁和δ-铁的铁原子堆积方式都为体心立方堆积,δ-铁配位数为6;
②如图所示,该晶胞中含有6个铁原子,晶胞棱长为acm,根据![]() ,则
,则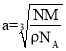 =
=![]() cm,面对角线是4个铁原子的半径,Fe原子半径
cm,面对角线是4个铁原子的半径,Fe原子半径![]() cm,即
cm,即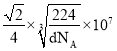 nm。
nm。


 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】下列解释实验事实的方程式不正确的是( )
A.0.1mol/L CH3COOH溶液的pH>1:CH3COOH![]() CH3COO-+H+
CH3COO-+H+
B.“NO2球”浸泡在冷水中,颜色变浅:2NO2(g) ![]() N2O4(g) △H<0
N2O4(g) △H<0
C.铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO=3Fe2++2NO↑+4H2O
D.向Na2CO3溶液中滴入酚酞溶液,溶液变红:![]() +H2O
+H2O![]()
![]() +OH-
+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】捕获二氧化碳生成甲酸的过程如图所示。下列说法不正确的是(NA 为阿伏加德罗常数的值) ( )
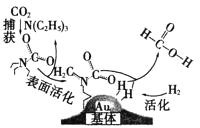
A.10.1gN(C2H5)3 中所含的共价键数目为 2.1NA
B.标准状况下,22.4LCO2 中所含的电子数目为 22NA
C.在捕获过程中,二氧化碳分子中的共价键完全断裂
D.100g 46%的甲酸水溶液中所含的氧原子数目为5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa的条件下,断裂1molH—H键吸收436kJ能量,断裂1molCl—Cl键吸收243kJ能量,形成1molH-Cl键放出431 kJ能量。H2+Cl2=2HCl的化学反应可用如图表示:
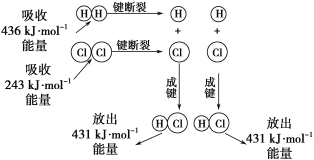
请回答下列有关问题:
(1)反应物断键吸收的总能量为___________________。
(2)生成物成键放出的总能量为______________。
(3)判断H2+Cl2=2HCl反应_____________(填“吸收”或“放出”)能量。
(4)反应物的总能量________(填“>”、“=”或“<”)生成物的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】费托合成是以合成气(CO 和 H2 混合气体)为原料在催化剂和适当条件下合成烯烃(C2~C4)以及烷烃(CH4、C5~C11、C12~C18 等,用Cn H2n+2 表示)的工艺过程。
已知:① 2CO(g) +O2(g) =2CO2 (g) △H1 =a
②2H2(g) + O2(g)=2H2O(g) △H2 =b
③![]()
回答下列问题:
(1)反应(2n +1)H2 (g)+nCO(g)=CnH2n+2(g)+nH2O(g)的 △H_____。(用含有a、b、c、n 的式子表示)
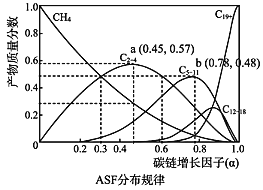
(2)费托合成产物碳原子分布遵循 ASF 分布规律。碳链增长因子(α)是描述产物分布的重要参数,不同数值对应不同的产物分布。ASF 分布规律如图,若要控制 C2~C4 的质量分数 0.48~0.57,则需控制碳链增长因子(α)的范围是________。
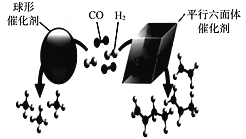
(3)近期,我国中科院上海高等研究院在费托合成烃的催化剂上取得重大进展。如图所示,Co2C作催化剂的规律是:选择球形催化剂时_____,选择平行六面体催化剂时_____。
(4)中科院大连化物所研究团队直接利用CO2 与H2 合成甲醇。一定条件下,向 2L 恒容密闭容器中充入1molCO2和 2mol H2发生反应“CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H”。CO2 的平衡转化率(α)与温度(T)的关系如图所示。
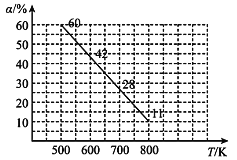
①判断△H_______0。(填“大于”“小于”或“等于”)
②500 K 时,反应 5 min 达到平衡。计算 0~5 min 用H2O 表示该反应的化学反应速率为_________,该反应的平衡常数为__________。
③500 K 时,测定各物质的物质的量浓度分别为 c(CO2)=0.4 mol/L、c(H2) = 0.2 mol/L、c(CH3OH) = 0.6 mol/L、c(H2O) = 0. 6 mol/L,此时反应____ (填“是”或“否”) 达到平衡,理由是_____ 。
④一定条件下,对于反应 CO2(g) + 3H2(g)CH3OH(g) + H2O(g)。下列说法中不能表明反应达到平衡的是_____。
a.恒温恒容下,c(CH3OH)=c(H2O)
b.恒温恒容下,体系的压强保持不变
c.恒温恒容下,体系的平均摩尔质量不变
d.相同时间内,断裂 H-H 键和断裂 H-O 键之比 1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:3Fe+4H2O(g)=Fe3O4+4H2。某化学小组的同学为探究铁与水蒸气的反应,并对所得产物进行检验,设计了如图所示的实验装置(尾气处理等装置已略去)并进行实验。

请回答下列问题:
(1)图中盛放碱石灰的仪器名称为______________。
(2)D装置中观察到的实验现象为_______________________。
(3)从安全角度考虑,实验过程中应先点燃的酒精灯为_____________(填“A”或“D”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇脱氢可制取甲醛:CH3OH(g) ![]() HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示。下列有关说法正确的是( )
HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示。下列有关说法正确的是( )
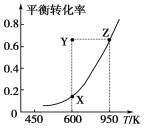
A. Q>0
B. 600 K时,Y点甲醇的v(正)<v(逆)
C. 从Y点到Z点可通过增大压强实现
D. 从Y点到X点可通过使用催化剂实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中氮氧化物和碳氢化合物受紫外线作用可产生一次污染物——光化学烟雾,其中部分物质的反应过程如图所示。下列说法正确的是( )

A.该过程中![]() 作催化剂B.反应过程中没有电子转移
作催化剂B.反应过程中没有电子转移
C.反应过程中氮氧化物不断被消耗D.丙烯转化为甲醛和乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:
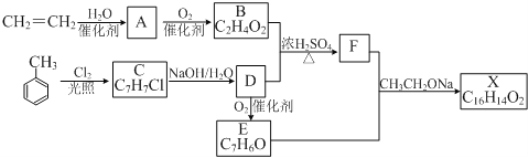
已知:![]() 。请回答:
。请回答:
(1)E中含氧官能团的名称是__________________。
(2)B+D→F的化学方程式____________,除F外图中与该反应类型相同的反应生成了_________(填A—F或X)。
(3)X的结构简式________关于化合物X,下列说法正确的是_______
A.能发生水解反应 B.不与浓硝酸发生取代反应
C.遇溴水会发生取代反应 D.能发生银镜反应
(4)写出一种同时符合下列条件的F的同分异构体,其结构简式为___________
ⅰ. 能发生银镜反应; ⅱ. 能使FeCl3(aq)显色;ⅲ. 有4中不同化学环境的氢原子
(5)乙烯是一种重要的化工原料。若在实验室想通过乙烯制备少量聚氯乙烯,写出可行的合成路线_________(其他无机原料任选)(合成路线的常用表示方法为:![]() 目标产物)
目标产物)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com