
【题目】费托合成是以合成气(CO 和 H2 混合气体)为原料在催化剂和适当条件下合成烯烃(C2~C4)以及烷烃(CH4、C5~C11、C12~C18 等,用Cn H2n+2 表示)的工艺过程。
已知:① 2CO(g) +O2(g) =2CO2 (g) △H1 =a
②2H2(g) + O2(g)=2H2O(g) △H2 =b
③![]()
回答下列问题:
(1)反应(2n +1)H2 (g)+nCO(g)=CnH2n+2(g)+nH2O(g)的 △H_____。(用含有a、b、c、n 的式子表示)
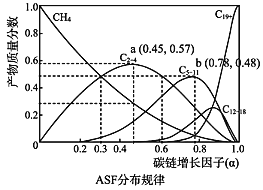
(2)费托合成产物碳原子分布遵循 ASF 分布规律。碳链增长因子(α)是描述产物分布的重要参数,不同数值对应不同的产物分布。ASF 分布规律如图,若要控制 C2~C4 的质量分数 0.48~0.57,则需控制碳链增长因子(α)的范围是________。
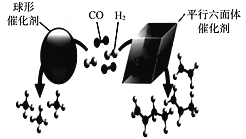
(3)近期,我国中科院上海高等研究院在费托合成烃的催化剂上取得重大进展。如图所示,Co2C作催化剂的规律是:选择球形催化剂时_____,选择平行六面体催化剂时_____。
(4)中科院大连化物所研究团队直接利用CO2 与H2 合成甲醇。一定条件下,向 2L 恒容密闭容器中充入1molCO2和 2mol H2发生反应“CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H”。CO2 的平衡转化率(α)与温度(T)的关系如图所示。
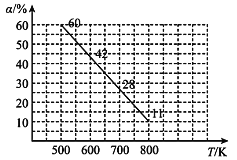
①判断△H_______0。(填“大于”“小于”或“等于”)
②500 K 时,反应 5 min 达到平衡。计算 0~5 min 用H2O 表示该反应的化学反应速率为_________,该反应的平衡常数为__________。
③500 K 时,测定各物质的物质的量浓度分别为 c(CO2)=0.4 mol/L、c(H2) = 0.2 mol/L、c(CH3OH) = 0.6 mol/L、c(H2O) = 0. 6 mol/L,此时反应____ (填“是”或“否”) 达到平衡,理由是_____ 。
④一定条件下,对于反应 CO2(g) + 3H2(g)CH3OH(g) + H2O(g)。下列说法中不能表明反应达到平衡的是_____。
a.恒温恒容下,c(CH3OH)=c(H2O)
b.恒温恒容下,体系的压强保持不变
c.恒温恒容下,体系的平均摩尔质量不变
d.相同时间内,断裂 H-H 键和断裂 H-O 键之比 1:1
【答案】![]() 0.3~0.6 主要产物为CH4 产物有CH2=CH2、C3H6、C4H8 小于 0.06 mol/(L ·min) 450(mol/L)-2 否
0.3~0.6 主要产物为CH4 产物有CH2=CH2、C3H6、C4H8 小于 0.06 mol/(L ·min) 450(mol/L)-2 否 ![]() ≠450
≠450![]() a
a
【解析】
(1)根据盖斯定律解答;
(2)由图可知要控制C2~C4的质量分数0.48~0.57是对应的数值范围;
(3)根据图示球棍模型的比例判断产物的分子式;
(4) ①右图可知随着温度升高CO2的平衡转化率降低,平衡逆向移动分析;
②根据![]() 计算;
计算;
③列 “三段式”,求算500K时平衡常数,比较Qc与平衡常数的大小判断;
④根据达到平衡状态时的特点分析。
(1)已知:① 2CO(g) +O2(g) =2CO2 (g) △H1 =a
②2H2(g) + O2(g)=2H2O(g) △H2 =b
③![]()
根据盖斯定律:![]() ×①+
×①+![]() ×②-③,可得反应(2n+1)H2(g)+nCO(g)=Cn
×②-③,可得反应(2n+1)H2(g)+nCO(g)=Cn![]() (g)+nH2O(g)的△H=
(g)+nH2O(g)的△H=![]() ;
;
(2)由图可知要控制C2~C4的质量分数0.48~0.57需控制碳链增长因子(α)的范围是0.3~0. 6;
(3)CO2C作催化剂的规律是:选择球形催化剂时主要产物为CH4,选择平行六面体催化剂时产物有CH2 =CH2、CH2 = CHCH3、CH2=CHCH2CH3或C2H4、C3H6、C4H8。
(4)①右图可知随着温度升高CO2的平衡转化率降低,故△H小于0。
②500 K 时,二氧化碳转化率为60%,即参与反应的物质的量为0.6mol,根据反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),水蒸气的变化物质的量为0.6mol,则![]() =0.06 mol/(L·min)。
=0.06 mol/(L·min)。
③初始时刻, CO2和H2的物质的量浓度分别为0.5mol/L、1 mol/L,500 K 时,二氧化碳转化率为60%,列“三段式”:
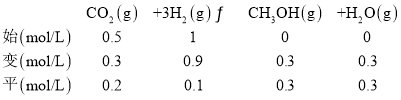
![]() ,代入数据
,代入数据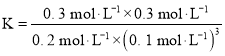
![]() ;
;![]() ≠
≠![]() ,反应未达到平衡状态;
,反应未达到平衡状态;
④反应CO2(g)+ 3H2(g)![]() CH3OH(g)+H2O(g)气体分子数减小。
CH3OH(g)+H2O(g)气体分子数减小。
a.若平衡正向建立必有c(CH3OH)=c(H2O),不能表明反应已达平衡,故a错误;
b.恒温恒容下,压强p~n,n必然变化,当p不变,表明反应已达平衡,故b正确;
c.反应物、产物均为气体,气体质量不变,n减小(增大),M=![]() 即M必然变化,当M不变,表明反应已达平衡,故c正确;
即M必然变化,当M不变,表明反应已达平衡,故c正确;
d.断裂H-H键(v正)断裂H-O键(v逆)1∶1,v正= v逆,表明反应已达平衡,故d正确;
答案选a。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】以硫酸渣(含Fe2O3、SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如下:
(1)“酸溶”中加快溶解的方法为____(写出一种)。
(2)“还原”过程中的离子方程式为_______。
(3)①“沉铁”过程中生成Fe(OH)2的化学方程式为_______。②若用CaCO3“沉铁”,则生成FeCO3沉淀。当反应完成时,溶液中c(Ca2+)/c(Fe2+)=________。[已知Ksp(CaCO3)=2.8×10-9,Ksp(FeCO3)=2×10-11]
(4)“氧化”时,用NaNO2浓溶液代替空气氧化Fe(OH)2浆液,能缩短氧化时间,但缺点是_________。
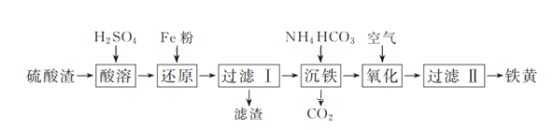
(5)焦炭还原硫酸渣炼铁能充分利用铁资源,在1225℃、n(C)/n(O)=1.2时,焙烧时间与金属产率的关系如图,时间超过15min金属产率下降的原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态钛原子的价电子排布式为_____________,与钛同周期的元素中,基态原子的未成对电子数与钛相同的有____________种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料,钛的硬度比铝大的原因是_________。
(3)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,则该配合离子的化学式为___________。
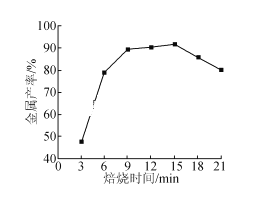
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。
①组成M的元素中,电负性最大的是_________(填名称)。
②M中碳原子的杂化方式为____________。
③M中不含________(填代号)。
a.π键 b.σ键 c.离子键 d.配位键
(5)金红石(TiO2)是含钛的主要矿物之一。其晶胞结构(晶胞中相同位置的原子相同)如图所示。
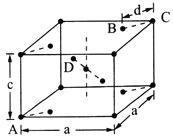
①A、B、C、D 4种微粒,其中氧原子是________(填代号)。
②若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,____,___);钛氧键的键长d=______(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,直到近年来人们才研究出来其成分为BaCuSi4O10,BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均具有Cun+离子,n=___,基态时该阳离子的价电子排布式为______。
(2)“中国蓝”的发色中心是以Cun+为中心离子的配位化合物,其中提供孤对电子的是___元素。
(3)合成“中国蓝”、“中国紫”的原料有BaCO3,孔雀石Cu2(OH)2CO3和砂子(SiO2)。SiO2晶体中Si原子的杂化轨道是由______轨道(填轨道的名称和数目)和________轨道杂化而成的。
(4)现代文物分析发现,“中国蓝”中含有微量硫元素。假若硫元素来源一种阴离子是正四面体的天然钡矿中,则最可能的钡矿化学式是______。
(5)在5500年前,古代埃及人就己经知道如何合成蓝色颜料—“埃及蓝”CaCuSi4O10,其合成原料中用CaCO3代替了BaCO3,其它和“中国蓝”一致。CO32一中键角∠OCO为___。根据所学,从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更___(填“高”或“低”)。
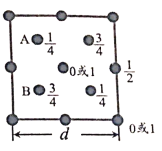
(6)自然界中的SiO2,硬度较大,主要原因是___。下图为SiO2晶胞中Si原子沿z轴方向在xy平面的投影图(即俯视投影图),其中O原子略去,Si原子旁标注的数字表示每个Si原子位于z轴的高度,则SiA与SiB的距离是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铵是一种传统的氮肥,某种制取硫酸铵的流程如下:
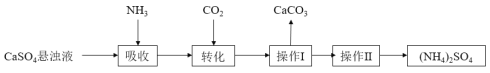
请回答下列问题:
(1)操作Ⅰ的名称为_________。
(2)在CaSO4悬浊液中通入NH3、CO2生成(NH4)2SO4的化学方程式________________。
(3)为测定硫酸铵的纯度,称取3.000g样品,溶于水,依次加入足量稀盐酸和足量BaCl2溶液,充分反应,过滤,沉淀经洗涤后烘干至恒重,得到4.660 g BaSO4。该硫酸铵的纯度为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用“棕色环”现象检验NO3— 离子。其方法为:取含有 NO3— 的溶液于试管中,加入 FeSO4 溶液振荡,然后沿着试管内壁加入浓 H2SO4,在溶液的界面上岀现“棕色环”。回答下列问题:
(1)基态 Fe2+核外未成对电子个数为_____。
(2)形成“棕色环”主要发生如下反应:
3[Fe( H2O)6]2+ + NO3-+4H+ =3[Fe(H2O)6]3+ + NO ↑+2H2O
[Fe( H2O)6]2+ + NO=[Fe(NO) (H2O)5]2+(棕色)+ H2O
[Fe(NO)(H2O)5]2+中,配体是______、______,配位数为______。
(3)与 NO 互为等电子体的微粒是_____ (任写一例)。
(4)SO42-的空间构型是_____,其中 S 原子的杂化方式是________ 。
(5)铁原子在不同温度下排列构成不同晶体结构,在 912℃以下排列构成的晶体叫做α-铁; 在 912℃至 1394℃之间排列构成的晶体叫做γ -铁;在 1394℃以上排列构成的晶体, 叫做δ-铁。晶胞剖面结构如图所示:
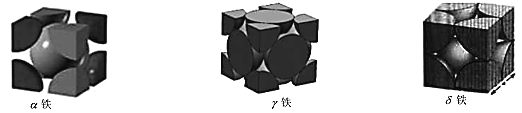
①α-铁的原子堆积方式为 _____ 。δ-铁配位数为 ____ 。
②已知γ-铁晶体密度为d g/cm3,则 Fe 原子的半径为____nm(用含 d、NA 的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能量的判断和表示方法正确的是
A.由C(s,石墨)=C(s,金刚石) H=+1.9 kJ/mol,可知:石墨比金刚石更稳定
B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多
C.由H+(aq)+OH-(aq) =H2O(l) H=-57.3 kJ/mol,可知:含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量等于57.3 kJ
D.2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g) =2H2O(l) H=-285.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,Fe与水并不发生反应,但在高温下,Fe与水蒸气可发生反应。高温下Fe与水蒸气的反应实验应使用如图所示的装置,在硬质玻璃管中放入铁粉和石棉绒的混合物,通入水蒸气并加热。请回答实验的相关问题。
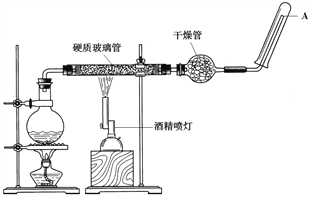
(1)该反应的反应方程式为_________。
(2)圆底烧瓶中装的是水,该装置的主要作用是______________;烧瓶底部放了几片碎瓷片,碎瓷片的作用是________________________。
(3)干燥管中盛装的物质是____________,作用是________________________。
(4)如果要在A处玻璃管口点燃该气体,则必须对该气体进行____________,方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫在自然界中以游离态和多种化合态形式出现,硫的化合物大多具有氧化性或还原性,许多金属硫化物难溶于水。完成下列填空:
(1)SO2能使KMnO4溶液褪色,还原产物是MnSO4,写出该反应的化学方程式__________。
(2)将SO2通入BaCl2溶液至饱和,未见沉淀生成,滴加溴水后,出现白色沉淀,该白色沉淀化学式为________。
(3)向Na2S固体中分别加入浓硫酸和稀硫酸,所得产物__________(填“相同”或“不同”),由此可知硫酸氧化性的强弱与__________有关。
(4)已知NaHSO3溶液显酸性,溶液中离子浓度由大到小的顺序是_____________。
(5)为了使Na2S溶液中c(Na+)/c(S2)的比值变小,可适量加入(或通入)的物质是___________
a.H2S气体 b.NaOH固体 c.HCl气体 d.KOH固体
(6)在图中,从A管通入一定量SO2后,在B处检测到有新的气体生成。B处排出的气体中(填“含”或“不含”)___________H2S。(已知:酸性H2SO4>H2CO3≈H2S)
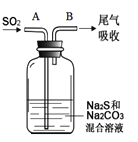
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com