
【题目】以硫酸渣(含Fe2O3、SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如下:
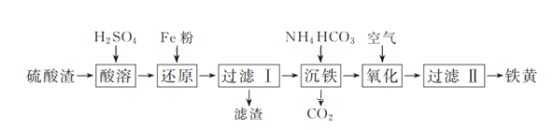
(1)“酸溶”中加快溶解的方法为____(写出一种)。
(2)“还原”过程中的离子方程式为_______。
(3)①“沉铁”过程中生成Fe(OH)2的化学方程式为_______。②若用CaCO3“沉铁”,则生成FeCO3沉淀。当反应完成时,溶液中c(Ca2+)/c(Fe2+)=________。[已知Ksp(CaCO3)=2.8×10-9,Ksp(FeCO3)=2×10-11]
(4)“氧化”时,用NaNO2浓溶液代替空气氧化Fe(OH)2浆液,能缩短氧化时间,但缺点是_________。
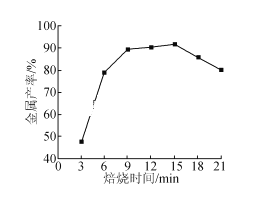
(5)焦炭还原硫酸渣炼铁能充分利用铁资源,在1225℃、n(C)/n(O)=1.2时,焙烧时间与金属产率的关系如图,时间超过15min金属产率下降的原因是_______。
【答案】加热或搅拌或适当增大硫酸浓度(写一种) Fe+2Fe3+=3Fe2+ FeSO4+2NH4HCO3=Fe(OH)2↓+(NH4)2SO4+2CO2↑ 140 NaNO2被还原为氮氧化物,污染空气 还原剂消耗完,空气进入使铁再次氧化
【解析】
(1)硫酸渣中Fe2O3溶于硫酸生成硫酸铁溶液,SiO2不溶于硫酸,加入过量铁粉,硫酸铁被还原为硫酸亚铁,滤液中加入碳酸氢铵,生成Fe(OH)2沉淀和二氧化碳,通入氧气Fe(OH)2被氧化为FeOOH。
(1)加热、搅拌或适当增大硫酸浓度可加快“酸溶”中溶解速率。
(2)“还原”过程中硫酸铁被铁粉还原为硫酸亚铁,反应的离子方程式为Fe+2Fe3+=3Fe2+。
(3)①“沉铁”过程中硫酸亚铁、碳酸氢铵反应生成Fe(OH)2、二氧化碳、硫酸铵,反应的化学方程式为FeSO4+2NH4HCO3= Fe(OH)2↓+(NH4)2SO4+2CO2↑。②若用CaCO3“沉铁”,则生成FeCO3沉淀。当反应完成时,溶液为碳酸钙、碳酸亚铁的饱和溶液,溶液中![]() ;
;
(4)“氧化”时,用NaNO2浓溶液代替空气氧化Fe(OH)2浆液,NaNO2被还原为氮氧化物,污染空气。
(5)焦炭还原硫酸渣炼铁,在1225℃、n(C)/n(O)=1.2时,焙烧时间超过15min,还原剂消耗完,空气进入使铁再次氧化,所以金属产率下降。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.已知t℃时,MgCO3的Ksp=4×10-6,则MgCO3饱和溶液中含Mg2+数目为2×10-3NA
B.一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数一定为0.1NA
C.CO2通过Na2O2使其增重bg时,反应中转移的电子数为![]()
D.1mol带有乙基支链的烷烃,分子中所含碳原子数最少为5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在可逆反应2A(g)+3B(g)![]() xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。则关于此反应的下列说法中正确的是( )
xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。则关于此反应的下列说法中正确的是( )
A.2 min末时A和B的浓度之比为5∶3
B.x=1
C.2 min末时B的浓度为1.5 mol·L-1
D.2 min末时A的消耗浓度为0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯是一种重要的化工原料,也是一种重要的溶剂。请回答下列问题:
⑴把苯加入到盛有溴水的试管中,液体会出现分层现象,充分振荡、静置,出现橙红色液体的一层在_______层(填“上”或“下”);
⑵把苯加入到盛有少量高锰酸钾溶液的试管中,振荡后,酸性高锰酸钾溶液不褪色,说明苯分子中________(填“有”或“没有”)碳碳双键;
⑶在浓硫酸作用下,苯在50~60℃可以与浓硝酸反应生成硝基苯,反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列元素或化合物的性质变化顺序正确的是__________________
A.第一电离能:Cl>S>P>Si
B.共价键的极性:HF>HCl>HBr>HI
C.晶格能:NaF>NaCl>NaBr>NaI
D.热稳定性:MgCO3>CaCO3>SrCO3>BaCO3
(2)FeCl3 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的 FeCl3 的结构式为_________,其中 Fe 的配位数为___________________
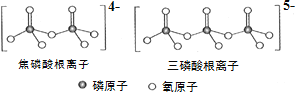
(3)NH4H2PO4 中,电负性最高的元素是________;P的________________杂化轨道与 O的2p轨道形成______键。NH4H2PO4 和 LiFePO4 属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐, 如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示。这类磷酸根离子的化学式可用通式表示为 ______________(用 n 代表 P 原子数)。
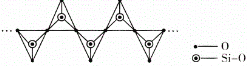
(4)高温高压下 CO2 的晶体结构与SiO2 相似,该晶体熔点比 SiO2 晶体____________(填“高”或“低”)。硅酸盐和 SiO2 一样,都是以硅氧四面体作为基本结构单元,图中表示一种含 n 个硅原子的单链式多硅酸根的结构(投影如图),Si 原子的杂化类型为_______________,其化学通式可表示为____________________
(5)四方晶系 CuFeS2 晶胞结构如图所示(下一页)。Cu2+的配位数为_______________,S2-的配位数为__已知:a=b=0.524 nm,c=1.032 nm,NA 为阿伏加德罗常数的值,CuFeS2晶体的密度是_________________ gcm-3(列出计算式)。
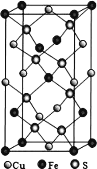
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验事实的方程式不正确的是( )
A.0.1mol/L CH3COOH溶液的pH>1:CH3COOH![]() CH3COO-+H+
CH3COO-+H+
B.“NO2球”浸泡在冷水中,颜色变浅:2NO2(g) ![]() N2O4(g) △H<0
N2O4(g) △H<0
C.铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO=3Fe2++2NO↑+4H2O
D.向Na2CO3溶液中滴入酚酞溶液,溶液变红:![]() +H2O
+H2O![]()
![]() +OH-
+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1000mol/LKOH溶液滴定未知浓度的盐酸溶液,其操作可分为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有KOH标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)B→__→__→__→__→F。
(2)上述(B)操作的目的是___。
(3)判断滴定到达终点的现象是___。
(4)若滴定开始和结束时,碱式滴定管中的液面如图所示,则起始读数为__mL,终点读数为___mL;所测盐酸溶液的浓度为___mol/L。

(5)若滴定终点读数时,俯视滴定管的刻度,其他操作均正确,则对滴定结果产生的影响是__。若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对滴定结果产生的影响是___。(填“偏高”、“偏低”、或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为某同学设计的检验浓硫酸和碳反应所得气体产物的实验装置图。下列说法正确的是

A. 若按①→③→②顺序连接,可检验所有气体产物
B. 若装置②只保留a、b,同样可以达到实验目的
C. 若圆底绕瓶内碳粉过量,充分反应后恢复到25℃,溶液的pH≥5.6
D. 实验结束后,应按从下往上、从左往右的顺序拆卸装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】费托合成是以合成气(CO 和 H2 混合气体)为原料在催化剂和适当条件下合成烯烃(C2~C4)以及烷烃(CH4、C5~C11、C12~C18 等,用Cn H2n+2 表示)的工艺过程。
已知:① 2CO(g) +O2(g) =2CO2 (g) △H1 =a
②2H2(g) + O2(g)=2H2O(g) △H2 =b
③![]()
回答下列问题:
(1)反应(2n +1)H2 (g)+nCO(g)=CnH2n+2(g)+nH2O(g)的 △H_____。(用含有a、b、c、n 的式子表示)
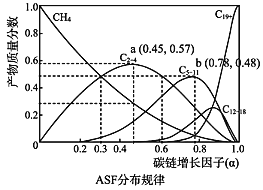
(2)费托合成产物碳原子分布遵循 ASF 分布规律。碳链增长因子(α)是描述产物分布的重要参数,不同数值对应不同的产物分布。ASF 分布规律如图,若要控制 C2~C4 的质量分数 0.48~0.57,则需控制碳链增长因子(α)的范围是________。
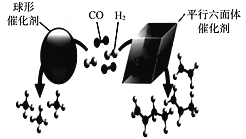
(3)近期,我国中科院上海高等研究院在费托合成烃的催化剂上取得重大进展。如图所示,Co2C作催化剂的规律是:选择球形催化剂时_____,选择平行六面体催化剂时_____。
(4)中科院大连化物所研究团队直接利用CO2 与H2 合成甲醇。一定条件下,向 2L 恒容密闭容器中充入1molCO2和 2mol H2发生反应“CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H”。CO2 的平衡转化率(α)与温度(T)的关系如图所示。
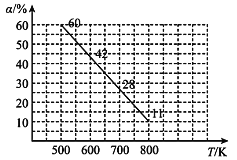
①判断△H_______0。(填“大于”“小于”或“等于”)
②500 K 时,反应 5 min 达到平衡。计算 0~5 min 用H2O 表示该反应的化学反应速率为_________,该反应的平衡常数为__________。
③500 K 时,测定各物质的物质的量浓度分别为 c(CO2)=0.4 mol/L、c(H2) = 0.2 mol/L、c(CH3OH) = 0.6 mol/L、c(H2O) = 0. 6 mol/L,此时反应____ (填“是”或“否”) 达到平衡,理由是_____ 。
④一定条件下,对于反应 CO2(g) + 3H2(g)CH3OH(g) + H2O(g)。下列说法中不能表明反应达到平衡的是_____。
a.恒温恒容下,c(CH3OH)=c(H2O)
b.恒温恒容下,体系的压强保持不变
c.恒温恒容下,体系的平均摩尔质量不变
d.相同时间内,断裂 H-H 键和断裂 H-O 键之比 1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com