
【题目】在可逆反应2A(g)+3B(g)![]() xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。则关于此反应的下列说法中正确的是( )
xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。则关于此反应的下列说法中正确的是( )
A.2 min末时A和B的浓度之比为5∶3
B.x=1
C.2 min末时B的浓度为1.5 mol·L-1
D.2 min末时A的消耗浓度为0.5 mol·L-1
【答案】C
【解析】
先根据反应速率求出2 min内 C的浓度变化量,根据变化量之比等于化学计量数之比,确定x的值及反应物的变化量。
变化量之比等于化学计量数之比。依题意2 min末c(C)=0.5mol·(L·min)-1×2 min=1 mol·L-1,而此时c(D)=0.5 mol·L-1,所以x=2。则前2 min A和B的变化量分别为1 mol·L-1和1.5 mol·L-1。
A. 2 min末时A和B的浓度之比为(5-1)∶(3-1.5)=8:3,A不正确;
B. x=2,B不正确;
C. 2 min末时B的浓度为1.5 mol·L-1,C正确;
D. 2 min末时A的消耗浓度与C的生成浓度相同,为1mol·L-1,D不正确。
可知C正确。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4.2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:
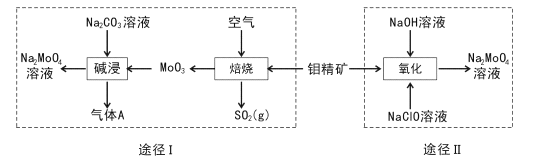
(l) Na2 MoO4![]() 2H2O中钼元素的化合价为____,NaCIO的电子式为 ___。
2H2O中钼元素的化合价为____,NaCIO的电子式为 ___。
(2)途径I为了提高钼精矿焙烧速率,可采取的措施是____(答出两条即可)。
(3)途径I焙烧过程中化学方程式为____,碱浸时气体A的化学式为____。
(4)已知途径I的钼酸钠溶液中c(MoO42-)=0. 40mol/L,c(CO32-)=0. 20mol/L。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。当BaMoO4开始沉淀时,CO32-的去除率是____(已知Ksp(BaCO3) =1×10-9、Ksp(BaMo04) =4.0×10-8,忽略溶液的体积变化)。
(5)途径II氧化时溶液中还有Na2SO4生成,则还原剂与氧化剂物质的量之比为_____。
(6)途径I或途径II所得的Na2MoO4溶液经结晶可得固体A后再重结晶可得固体B,其重结晶操作的目的为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨在自然界主要以钨(+6价)酸盐的形式存在。黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成FeWO4、MnWO4。黑钨矿冶炼金属钨的流程如下图(已知:钨酸是一种难溶性强酸、对热不稳定)。其中A、B、C都是钨的化合物。完成下列填空:

(1)上述从黑钨矿获得单质钨的过程中属于氧化还原反应的是(填数字序号)__________。
(2)操作①的名称为__________,得到的滤液为钨酸的钠盐,写出反应②的化学方程式______________。该过程中产品C为_________,从产品C获得纯度较高的钨的另一反应原料应该为___________。
(3)若制得的钨中含有少量金属铁,为测定其中金属钨的含量(已知金属钨不溶于盐酸),甲同学用下列装置进行测定:
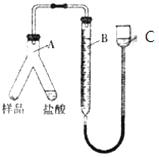
相关实验步骤:
①加好称量好的样品和盐酸,记录B的液面位置;
②检查气密性。
③待A中不再有气体产生并恢复至室温后,记录B的液面位置;
④将A中盐酸与样品混合;
正确的操作顺序是_________________(填序号)
(4)若实验用样品的质量为a g,加入20mL盐酸与之充分反应后,测得排出水的体积为VL(标准状况下),测得的H2的体积应为___________L,样品中的钨的质量分数的计算式为______________。
(5)在读取C装置液面数据时,应先____________,再平视读数,若样品中含有不溶于酸,也不与酸反应的物质,则测得钨的质量分数将_________(填“偏大”、“偏小”或“不受影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁元素、氮元素有多种可变价态,在氧化还原反应中常以不同价态出现,根据题中信息,完成下列填空:
(1)金属与硝酸反应通常还会生成NO和NO2,当n(NO): n(NO2)<1时,产生的气体可以完全被氢氧化钠溶液吸收,写出除去这两种气体的方法,以化学方程式表示_________、_______
(2)室温下,0.1mol/L的亚硝酸、次氯酸钠的电离常数HNO2:Ki =7.1× 10-4, HClO: Ki =2.98× 10-8,将0.1mol/L的亚硝酸稀释100倍,c(H+)=将(填“不变”、“增大”、“减小”)_______;Ki值将(填“不变”、“增大”、“减小”)_______。写出HNO2、HClO、NaNO2、NaClO四种物质,可能相互之间发生的离子互换反应的离子方程式_________。
(3)亚硝酸钠与氯酸钠都是白色粉末,且都有咸味,但亚硝酸盐都有毒性,通常它们可以通过加入热的白醋鉴别,亚硝酸钠遇到白醋会产生红棕色刺激性气味气体,该气体为______;实验室鉴别氯化钠和亚硝酸钠的方法之一是测定等浓度NaNO2、NaClO的pH,其鉴别的理由是______________。
(4)现有11.2g铁单质恰好与稀硝酸反应,生成无污染的单质气体,该单质气体为________,在反应后的溶液中加入铜粉,铜粉可以继续溶解,且无气体生成,铁与稀硝酸的反应产物中一定含有的金属阳离子是______,若反应后的溶液最多可溶解铜粉6.4g,写出上述过程中铁与稀硝酸反应的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属及其化合物的不合理的是( )
A. 将废铁屑加入![]() 溶液中,可用于除去工业废气中的
溶液中,可用于除去工业废气中的![]()
B. 铝中添加适量钾,制得低密度、高强度的铝合金,可用于航空工业
C. 盐碱地(含较多![]() 等)不利于作物生长,可施加熟石灰进行改良
等)不利于作物生长,可施加熟石灰进行改良
D. 无水![]() 呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol·L-1r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( )

A. 原子半径的大小W <X<Y B. 元素的非金属性Z>X>Y
C. Y的氢化物常温常压下为液态 D. X的最高价氧化物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
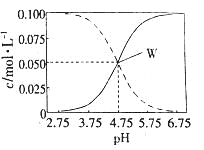
【题目】室温条件下在醋酸、醋酸钠混合溶液中,当c(CH3COOH)+c(CH3COO-)=0.lmol.L-1时,c(CH3COOH)、
c(CH3COO-)与pH的关系如图所示。下列有关叙述正确的是
 [
[
A.pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)+c(OH-)
B.向W点所表示的1.0L溶液中通人0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-)
C.pH=3.5的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol.L-l
D.W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH)-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫酸渣(含Fe2O3、SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如下:
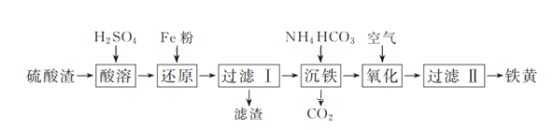
(1)“酸溶”中加快溶解的方法为____(写出一种)。
(2)“还原”过程中的离子方程式为_______。
(3)①“沉铁”过程中生成Fe(OH)2的化学方程式为_______。②若用CaCO3“沉铁”,则生成FeCO3沉淀。当反应完成时,溶液中c(Ca2+)/c(Fe2+)=________。[已知Ksp(CaCO3)=2.8×10-9,Ksp(FeCO3)=2×10-11]
(4)“氧化”时,用NaNO2浓溶液代替空气氧化Fe(OH)2浆液,能缩短氧化时间,但缺点是_________。
(5)焦炭还原硫酸渣炼铁能充分利用铁资源,在1225℃、n(C)/n(O)=1.2时,焙烧时间与金属产率的关系如图,时间超过15min金属产率下降的原因是_______。
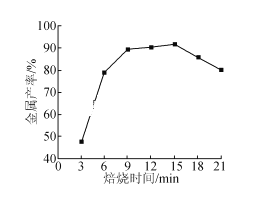
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态钛原子的价电子排布式为_____________,与钛同周期的元素中,基态原子的未成对电子数与钛相同的有____________种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料,钛的硬度比铝大的原因是_________。
(3)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,则该配合离子的化学式为___________。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。
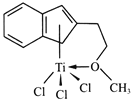
①组成M的元素中,电负性最大的是_________(填名称)。
②M中碳原子的杂化方式为____________。
③M中不含________(填代号)。
a.π键 b.σ键 c.离子键 d.配位键
(5)金红石(TiO2)是含钛的主要矿物之一。其晶胞结构(晶胞中相同位置的原子相同)如图所示。
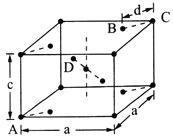
①A、B、C、D 4种微粒,其中氧原子是________(填代号)。
②若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,____,___);钛氧键的键长d=______(用代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com