
【题目】钼酸钠晶体(Na2MoO4.2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:
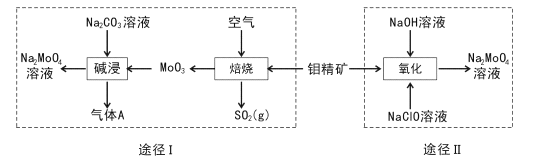
(l) Na2 MoO4![]() 2H2O中钼元素的化合价为____,NaCIO的电子式为 ___。
2H2O中钼元素的化合价为____,NaCIO的电子式为 ___。
(2)途径I为了提高钼精矿焙烧速率,可采取的措施是____(答出两条即可)。
(3)途径I焙烧过程中化学方程式为____,碱浸时气体A的化学式为____。
(4)已知途径I的钼酸钠溶液中c(MoO42-)=0. 40mol/L,c(CO32-)=0. 20mol/L。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。当BaMoO4开始沉淀时,CO32-的去除率是____(已知Ksp(BaCO3) =1×10-9、Ksp(BaMo04) =4.0×10-8,忽略溶液的体积变化)。
(5)途径II氧化时溶液中还有Na2SO4生成,则还原剂与氧化剂物质的量之比为_____。
(6)途径I或途径II所得的Na2MoO4溶液经结晶可得固体A后再重结晶可得固体B,其重结晶操作的目的为____。
【答案】+6 ![]() 充分粉碎钼精矿,加压增大氧气浓度,升高温度等 2MoS2+7O2
充分粉碎钼精矿,加压增大氧气浓度,升高温度等 2MoS2+7O2![]() 2MoO3+4SO2 CO2 95% 1:9 除去其它可溶性杂质,便于得到更纯净的钼酸钠晶体
2MoO3+4SO2 CO2 95% 1:9 除去其它可溶性杂质,便于得到更纯净的钼酸钠晶体
【解析】
(l) Na2 MoO4.2H2O中根据各元素化合价的代数和为零,计算钼元素的化合价为+6价;NaClO为离子化合物,其的电子式为![]() ;
;
(2) 途径I为了提高钼精矿焙烧速率,粉碎钼精矿增大接触面积,增加氧气的浓度或升高温度;
(3)途径I焙烧过程中,反应物为氧气、钼精矿,产物为二氧化硫和三氧化钼,反应方程式为:2MoS2+7O2![]() 2MoO3+4SO2;根据元素守恒,产物Na2MoO4中无碳元素,则气体中含碳元素,气体A为二氧化碳,则碱浸时气体A的化学式为CO2;
2MoO3+4SO2;根据元素守恒,产物Na2MoO4中无碳元素,则气体中含碳元素,气体A为二氧化碳,则碱浸时气体A的化学式为CO2;
(4)根据Ksp(BaMo04) =4.0×10-8, BaMoO4开始沉淀时,则c(Ba2+)= Ksp(BaMo04)/c(Mo042-)=4.0×10-8/0. 40=1.0×10-7 mol/L,此时溶液中c(CO32-)= Ksp(BaCO3)/ c(Ba2+)=1×10-9/1.0×10-7=0.01mol/L,CO32-的去除率=(0. 20mol/L-0.01mol/L)/0. 20mol/L=95%;
(5)途径II氧化时还原剂为MoS2、氧化剂为NaClO, 生成物为Na2SO4和Na2 MoO4,反应中Mo化合价由+4价变为+6价,S由-2变为+6,1mol MoS2失去16mol电子,NaClO中Cl的化合价由+1变为-1,1mol得到2mol电子,则还原剂与氧化剂物质的量之比1:9;
(6) 重结晶为根据可溶物的溶解度不同,利用多次结晶得到较纯的物质,其操作的目的为除去其它可溶性杂质,便于得到更纯净的钼酸钠晶体;
(l) Na2 MoO4.2H2O中根据各元素化合价的代数和为零,计算钼元素的化合价为+6价;NaClO为离子化合物,其的电子式为![]() ;
;
(2) 途径I为了提高钼精矿焙烧速率,粉碎钼精矿增大接触面积,增加氧气的浓度或升高温度,答案为:充分粉碎钼精矿,加压增大氧气浓度,升高温度等;
(3)途径I焙烧过程中,反应物为氧气、钼精矿,产物为二氧化硫和三氧化钼,反应方程式为:2MoS2+7O2![]() 2MoO3+4SO2;根据元素守恒,产物Na2MoO4中无碳元素,则气体中含碳元素,气体A为二氧化碳,则碱浸时气体A的化学式为CO2;
2MoO3+4SO2;根据元素守恒,产物Na2MoO4中无碳元素,则气体中含碳元素,气体A为二氧化碳,则碱浸时气体A的化学式为CO2;
(4)根据Ksp(BaMo04) =4.0×10-8, BaMoO4开始沉淀时,则c(Ba2+)= Ksp(BaMo04)/c(Mo042-)=4.0×10-8/0. 40=1.0×10-7 mol/L,此时溶液中c(CO32-)= Ksp(BaCO3)/ c(Ba2+)=1×10-9/1.0×10-7=0.01mol/L,CO32-的去除率=(0. 20mol/L-0.01mol/L)/0. 20mol/L=95%;
(5)途径II氧化时还原剂为MoS2、氧化剂为NaClO, 生成物为Na2SO4和Na2 MoO4,反应中Mo化合价由+4价变为+6价,S由-2变为+6,1mol MoS2失去16mol电子,NaClO中Cl的化合价由+1变为-1,1mol得到2mol电子,则还原剂与氧化剂物质的量之比1:9;
(6) 重结晶为根据可溶物的溶解度不同,利用多次结晶得到较纯的物质,其操作的目的为除去其它可溶性杂质,便于得到更纯净的钼酸钠晶体;


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
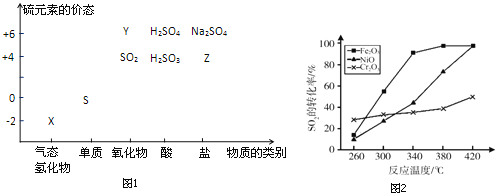
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要视角.硫及其化合物与价态变化为坐标的二维转化关系如图1所示.
完成下列填空:
(1)图中X的电子式为__;其水溶液在空气中放置易变浑浊,写出反应的化学方程式__;该变化说明S的非金属性比O__(填“强”或“弱”),从原子结构的角度解释原因:__.通过__(举两例),也可以判断氧、硫两种元素的非金属性强弱.
(2)下列物质用于Na2S2O3制备,从氧化还原反应的角度,理论上有可能的是__(选填编号).
a Na2S+S b Z+S c Na2SO3+Y d NaHS+NaHSO3
(3)已知反应:Na2S2O3+H2SO4→Na2SO4+S↓+SO2+H2O,研究其反应速率时,下列方案合理的是__(选填编号).
a 测定一段时间内生成SO2的体积,得出该反应的速率
b 研究浓度、温度等因素对该反应速率的影响,比较反应出现浑浊的时间
c 用Na2S2O3固体分别与浓、稀硫酸反应,研究浓度对该反应速率的影响
(4)治理含CO、SO2的烟道气,以Fe2O3做催化剂,将CO、SO2在380℃时转化为S和一种无毒气体.已知:①硫的熔点:112.8℃、沸点:444.6℃;②反应每得到1mol硫,放出270kJ的热量.写出该治理烟道气反应的热化学方程式__.
(5)其他条件相同、催化剂不同时,上述反应中SO2的转化率随反应温度的变化如图2.不考虑催化剂价格因素,生产中选Fe2O3做催化剂的主要原因是__.
查看答案和解析>>
科目:高中化学 来源: 题型:
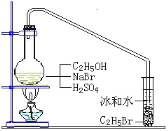
【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室中制备溴乙烷(C2H5Br)通常采用以下方法:在烧瓶中加NaBr(约2-3g)、适量水和少量乙醇,再加两倍于乙醇体积的浓硫酸(1:1),塞上带有长导管的塞子,长导管的另一端插入装有冰水混合物的试管中,用酒精灯隔石棉网对反应物加热(如图所示)。用此装置也可制备一些其它的卤代烃,如:1-溴丁烷等。可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下,请回答下列问题:
乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
密度/gcm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(1)写出该方法制备溴乙烷(C2H5Br)的化学方程式_____
(2)图中的试管放入冰水混合物的目的是_____。
(3)制备操作中,加入的浓硫酸必需进行稀释,目的是_____。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是_____(填字母)。
a.NaI b.NaOH c.NaHSO3 d.KCl
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于_____;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
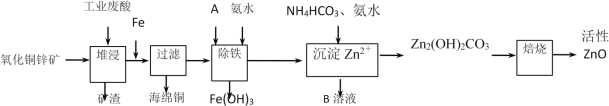
【题目】某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿,提取锌、铜元素,实现废物综合利用,方案如图所示:
已知:各离子开始沉淀及完全沉淀时的pH如表所示。
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 6.34 | 9.7 |
Fe3+ | 1.48 | 3.2 |
Zn2+ | 6.2 | 8.0 |
请回答下列问题:
(1)加入A物质的目的是___,物质A可使用下列物质中的___。
A.KMnO4 B.O2 C.H2O2 D.Cl2
(2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)___Ksp(ZnS)(选填“>”“<”或“=”)。
(3)反应生成海绵铜的离子方程式:___。
(4)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在___范围之间。
(5)写出NH4HCO3溶液与Zn2+反应生成Zn2(OH)2CO3的离子方程式:___。
(6)物质B可用作生产化肥,其化学式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制FeCl3溶液时,将FeCl3固体溶解在较浓的盐酸中,再加水稀释。下列说法正确的是
A.较浓盐酸可有效抑制Fe3+水解
B.稀释过程中FeCl3水解程度增大,c(H+)增大
C.FeCl3溶液中存在Fe3++3H2O=Fe(OH)3↓+3H+
D.FeCl3溶液显黄色,没有Fe(OH)3存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Bodensteins研究了下列反应:2HI(g)![]() H2(g)+I2(g) ΔH=+11 kJ/mol。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g) ΔH=+11 kJ/mol。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |

由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当改变条件,再次达到平衡时,下列有关叙述不正确的是
A.若升高温度到某一温度,再次达到平衡时,相应点可能分别是A、E
B.若再次充入a mol HI,则达到平衡时,相应点的横坐标值不变,纵坐标值增大
C.若改变的条件是增大压强,再次达到平衡时,相应点与改变条件前相同
D.若改变的条件是使用催化剂,再次达到平衡时,相应点与改变条件前不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钼在工业和国防建设中有重要的作用。钼(Mo)的常见化合价为+6、+5、+4。由钼精矿(主要成分是MoS2)可制备单质钼和钼酸钠晶体(Na2MoO4·2H2O),部分流程如图1所示:
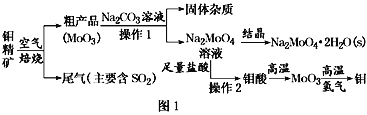
已知:钼酸微溶于水,可溶于液碱和氨水。
回答下列问题:
(1)焙烧钼精矿时发生的化学方程式为_____________________________。
(2)钼精矿焙烧时排放的尾气对环境的主要危害是___________________,请提出一种实验室除去该尾气的方法____________________________________。
(3)操作2的名称为________。由钼酸得到MoO3所用到的硅酸盐材料仪器的名称是________。
(4)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。
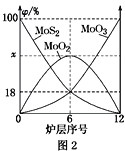
①x=________。
②焙烧炉中也会发生MoS2与MoO3反应生成MoO2和SO2的反应,若该反应转移6mol电子,则消耗的氧化剂的化学式及物质的量分别为________、________。
(5)操作1中,加入碳酸钠溶液充分反应后,碱浸液中c(MoO42-)=0.80mol·L1,c(SO42-)=0.04 mol·L1,在结晶前需加入Ba(OH)2固体以除去溶液中的SO42-。当BaMoO4开始沉淀时,SO42-的去除率是________。[Ksp(BaSO4)=1.1×1010、Ksp(BaMoO4)=4.0×108,溶液体积变化可忽略不计]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.已知t℃时,MgCO3的Ksp=4×10-6,则MgCO3饱和溶液中含Mg2+数目为2×10-3NA
B.一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数一定为0.1NA
C.CO2通过Na2O2使其增重bg时,反应中转移的电子数为![]()
D.1mol带有乙基支链的烷烃,分子中所含碳原子数最少为5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在可逆反应2A(g)+3B(g)![]() xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。则关于此反应的下列说法中正确的是( )
xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。则关于此反应的下列说法中正确的是( )
A.2 min末时A和B的浓度之比为5∶3
B.x=1
C.2 min末时B的浓度为1.5 mol·L-1
D.2 min末时A的消耗浓度为0.5 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com