
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.已知t℃时,MgCO3的Ksp=4×10-6,则MgCO3饱和溶液中含Mg2+数目为2×10-3NA
B.一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数一定为0.1NA
C.CO2通过Na2O2使其增重bg时,反应中转移的电子数为![]()
D.1mol带有乙基支链的烷烃,分子中所含碳原子数最少为5NA
科目:高中化学 来源: 题型:
【题目】根据要求填空
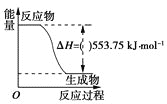
(1)打火机、运动会中的火炬一般采用丙烷(C3H8)为燃料。丙烷热值较高,污染较小,是一种优良的燃料。已知一定量丙烷完全燃烧生成CO2和1molH2O(l)过程中的能量变化如图,请写出表示丙烷燃烧热的热化学方程式:__。
(2)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:
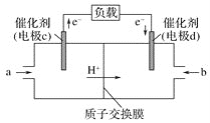
①电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是__(填“正极”或“负极”),c电极的反应方程式为___。
②用该燃料电池电解1L饱和食盐水(足量),当燃料电池消耗0.56L(标准状况下)氧气时,溶液pH=___(不考虑溶液体积变化)。
(3)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是__,该反应能设计成原电池的原因是__。A是__(填物质名称)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4.2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:
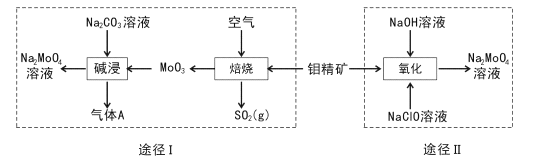
(l) Na2 MoO4![]() 2H2O中钼元素的化合价为____,NaCIO的电子式为 ___。
2H2O中钼元素的化合价为____,NaCIO的电子式为 ___。
(2)途径I为了提高钼精矿焙烧速率,可采取的措施是____(答出两条即可)。
(3)途径I焙烧过程中化学方程式为____,碱浸时气体A的化学式为____。
(4)已知途径I的钼酸钠溶液中c(MoO42-)=0. 40mol/L,c(CO32-)=0. 20mol/L。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。当BaMoO4开始沉淀时,CO32-的去除率是____(已知Ksp(BaCO3) =1×10-9、Ksp(BaMo04) =4.0×10-8,忽略溶液的体积变化)。
(5)途径II氧化时溶液中还有Na2SO4生成,则还原剂与氧化剂物质的量之比为_____。
(6)途径I或途径II所得的Na2MoO4溶液经结晶可得固体A后再重结晶可得固体B,其重结晶操作的目的为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下气体反应达到化学平衡,平衡常数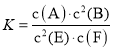 。恒容时,若温度适当降低,F的浓度增加。下列说法正确的是
。恒容时,若温度适当降低,F的浓度增加。下列说法正确的是
A.恒容时,向容器中充入稀有气体,反应速率不变
B.增大c(A)、c(B),K增大
C.该反应的化学方程式为2E(g)+F(s)A(g)+2B(g)
D.正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备CuSO4·5H2O,主要步骤如下:
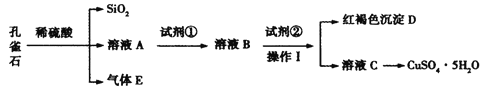
已知该条件下,通过调节溶液的酸碱性而使 Fe3+、Fe2+、Cu2+生成沉淀的 pH 分别如下:
物质 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe(OH)3 | 2.2 | 3.2 |
Fe(OH)2 | 7.6 | 9.6 |
Cu(OH)2 | 4.7 | 6.4 |
请回答下列问题:
(1)为了提高孔雀石酸浸时的速率,除适当增加浓硫酸浓度外,还可以采取的措施有:___(写一种)。
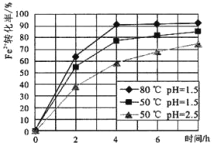
(2)试剂①是双氧水,把 Fe2+氧化成 Fe3+的目的是___。根据如图有关数据,你认为工业上氧化操作时应采取的条件是___。
(3)试剂②为CuO,其目的是调节溶液的 pH 保持在___范围。操作Ⅰ的名称是___。
(4)溶液 C 得到CuSO4·5H2O的主要步骤是___、___、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·惠廷厄姆与吉野彰这三位被称为“锂电池之父”的科学家,以表彰他们在锂离子电池领域作出的突出贡献。如图是一种最新研制的聚合物锂电池,a极为含有Li、Co、Ni、Mn、O等元素组成的混盐,电解质为一种能传导Li+的高分子复合材料,b极为镶嵌金属锂的石墨烯材料,反应原理为:LixC6+Li3-xNiCoMnO6![]() C6+Li3NiCoMnO6。下列说法正确的是( )
C6+Li3NiCoMnO6。下列说法正确的是( )

A.充电时,Li+向电池的a极移动
B.放电时,电池的负极反应为LixC6-xe-=xLi++C6
C.充电时若转移的电子数为3.01×1023个,两极材料质量变化相差0.7g
D.该电池若采用盐酸、稀硫酸等酸性溶液作为电解质溶液,工作效率会更高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨在自然界主要以钨(+6价)酸盐的形式存在。黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成FeWO4、MnWO4。黑钨矿冶炼金属钨的流程如下图(已知:钨酸是一种难溶性强酸、对热不稳定)。其中A、B、C都是钨的化合物。完成下列填空:

(1)上述从黑钨矿获得单质钨的过程中属于氧化还原反应的是(填数字序号)__________。
(2)操作①的名称为__________,得到的滤液为钨酸的钠盐,写出反应②的化学方程式______________。该过程中产品C为_________,从产品C获得纯度较高的钨的另一反应原料应该为___________。
(3)若制得的钨中含有少量金属铁,为测定其中金属钨的含量(已知金属钨不溶于盐酸),甲同学用下列装置进行测定:
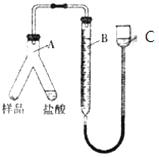
相关实验步骤:
①加好称量好的样品和盐酸,记录B的液面位置;
②检查气密性。
③待A中不再有气体产生并恢复至室温后,记录B的液面位置;
④将A中盐酸与样品混合;
正确的操作顺序是_________________(填序号)
(4)若实验用样品的质量为a g,加入20mL盐酸与之充分反应后,测得排出水的体积为VL(标准状况下),测得的H2的体积应为___________L,样品中的钨的质量分数的计算式为______________。
(5)在读取C装置液面数据时,应先____________,再平视读数,若样品中含有不溶于酸,也不与酸反应的物质,则测得钨的质量分数将_________(填“偏大”、“偏小”或“不受影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁元素、氮元素有多种可变价态,在氧化还原反应中常以不同价态出现,根据题中信息,完成下列填空:
(1)金属与硝酸反应通常还会生成NO和NO2,当n(NO): n(NO2)<1时,产生的气体可以完全被氢氧化钠溶液吸收,写出除去这两种气体的方法,以化学方程式表示_________、_______
(2)室温下,0.1mol/L的亚硝酸、次氯酸钠的电离常数HNO2:Ki =7.1× 10-4, HClO: Ki =2.98× 10-8,将0.1mol/L的亚硝酸稀释100倍,c(H+)=将(填“不变”、“增大”、“减小”)_______;Ki值将(填“不变”、“增大”、“减小”)_______。写出HNO2、HClO、NaNO2、NaClO四种物质,可能相互之间发生的离子互换反应的离子方程式_________。
(3)亚硝酸钠与氯酸钠都是白色粉末,且都有咸味,但亚硝酸盐都有毒性,通常它们可以通过加入热的白醋鉴别,亚硝酸钠遇到白醋会产生红棕色刺激性气味气体,该气体为______;实验室鉴别氯化钠和亚硝酸钠的方法之一是测定等浓度NaNO2、NaClO的pH,其鉴别的理由是______________。
(4)现有11.2g铁单质恰好与稀硝酸反应,生成无污染的单质气体,该单质气体为________,在反应后的溶液中加入铜粉,铜粉可以继续溶解,且无气体生成,铁与稀硝酸的反应产物中一定含有的金属阳离子是______,若反应后的溶液最多可溶解铜粉6.4g,写出上述过程中铁与稀硝酸反应的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫酸渣(含Fe2O3、SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如下:
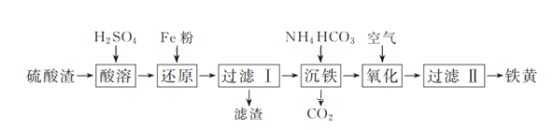
(1)“酸溶”中加快溶解的方法为____(写出一种)。
(2)“还原”过程中的离子方程式为_______。
(3)①“沉铁”过程中生成Fe(OH)2的化学方程式为_______。②若用CaCO3“沉铁”,则生成FeCO3沉淀。当反应完成时,溶液中c(Ca2+)/c(Fe2+)=________。[已知Ksp(CaCO3)=2.8×10-9,Ksp(FeCO3)=2×10-11]
(4)“氧化”时,用NaNO2浓溶液代替空气氧化Fe(OH)2浆液,能缩短氧化时间,但缺点是_________。
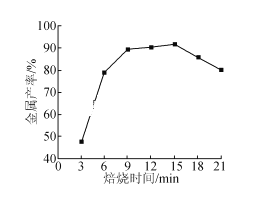
(5)焦炭还原硫酸渣炼铁能充分利用铁资源,在1225℃、n(C)/n(O)=1.2时,焙烧时间与金属产率的关系如图,时间超过15min金属产率下降的原因是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com