
【题目】铁元素、氮元素有多种可变价态,在氧化还原反应中常以不同价态出现,根据题中信息,完成下列填空:
(1)金属与硝酸反应通常还会生成NO和NO2,当n(NO): n(NO2)<1时,产生的气体可以完全被氢氧化钠溶液吸收,写出除去这两种气体的方法,以化学方程式表示_________、_______
(2)室温下,0.1mol/L的亚硝酸、次氯酸钠的电离常数HNO2:Ki =7.1× 10-4, HClO: Ki =2.98× 10-8,将0.1mol/L的亚硝酸稀释100倍,c(H+)=将(填“不变”、“增大”、“减小”)_______;Ki值将(填“不变”、“增大”、“减小”)_______。写出HNO2、HClO、NaNO2、NaClO四种物质,可能相互之间发生的离子互换反应的离子方程式_________。
(3)亚硝酸钠与氯酸钠都是白色粉末,且都有咸味,但亚硝酸盐都有毒性,通常它们可以通过加入热的白醋鉴别,亚硝酸钠遇到白醋会产生红棕色刺激性气味气体,该气体为______;实验室鉴别氯化钠和亚硝酸钠的方法之一是测定等浓度NaNO2、NaClO的pH,其鉴别的理由是______________。
(4)现有11.2g铁单质恰好与稀硝酸反应,生成无污染的单质气体,该单质气体为________,在反应后的溶液中加入铜粉,铜粉可以继续溶解,且无气体生成,铁与稀硝酸的反应产物中一定含有的金属阳离子是______,若反应后的溶液最多可溶解铜粉6.4g,写出上述过程中铁与稀硝酸反应的化学方程式___________。
【答案】2NaOH+ NO2+ NO = 2NaNO2 +H2O 2NaOH+NO2 = NaNO2 + NaNO3 + H2O 减小 不变 HNO2+ClO2-=NO2- + HClO NO2 亚硝酸是弱酸,亚硝酸钠水解显碱性,氯化钠不水解,为中性,所以他们同浓度的盐溶液的pH不同 N2 Fe3+ 10Fe+36HNO3 =10Fe(NO3)3+3N2↑+18H2O
【解析】
(1) NO、NO2按1: 1混合时,与三氧化二氮,与氢氧化钠反应生成亚硝酸钠,由于n(NO):n(NO2)<1,上述反应剩余二 氧化氮,二氧化氮与氢氧化钠反应生成硝酸钠、亚硝酸钠与水;
(2)亚硝酸为弱电解质,亚硝酸稀释,电离程度虽然增大,但溶液中氢离子浓度降低;其电离常数只与温度有关;
(3)红棕色刺激性气味气体为NO2;亚硝酸是弱酸,亚硝酸钠水解显碱性,氯化钠不水解,溶液为中性;
(4)铁单质恰好与稀硝酸反应,生成无污染的单质气体,该单质气体为N2,在反应后的溶液中加入铜粉,铜粉可以继续溶解,且无气体生成,则溶液中含有Fe3+ ,根据电子转移守恒,书写反应方程式。
(1)NO、NO2按1:1混合时,与三氧化二氮,与氢氧化钠反应生成亚硝酸钠,由于n(NO): n(NO2) < 1,上述反应剩余二氧化氮,二氧化氮与氢氧化钠反应生成硝酸钠、亚硝酸钠与水,相应化学方程式为: 2NaOH+ NO2+ NO = 2NaNO2 +H2O;2NaOH+NO2 = NaNO2 + NaNO3 + H2O,故答案为:2NaOH+ NO2+ NO = 2NaNO2 +H2O (2). 2NaOH+NO2 = NaNO2 + NaNO3 + H2O;
(2)亚硝酸为弱电解质,亚硝酸稀释,电离程度虽然增大,但溶液中氢离子浓度降低;其电离常数只与温度有关,与浓度无关,K值不发生变化;由相同浓度亚硝酸、次氯酸电离常数可知,亚硫酸酸性比次氯酸强,可能相互之间发生的离子互换,反应的离子方程式为:HNO2+ClO2-=NO2- + HClO,故答案为:减小;不变;HNO2+ClO2-=NO2- + HClO;
(3)红棕色刺激性气味气体为NO2;亚硝酸是弱酸,亚硝酸钠水解显碱性,氯化钠不水解,溶液为中性,所以他们同浓度的盐溶液的pH不同,故答案为:NO2;亚硝酸是弱酸,亚硝酸钠水解显碱性,氯化钠不水解,为中性,所以他们同浓度的盐溶液的pH不同;
(4)铁单质恰好与稀硝酸反应,生成无污染的单质气体,该单质气体为N2,在反应后的溶液中加入铜粉,铜粉可以继续溶解,且无气体生成,则溶液中含有Fe3+,6.4gCu为0.1mol,根据电子转移守恒,溶液中n(Fe3+)=![]() = 0.2mol,而n(Fe)=
= 0.2mol,而n(Fe)=![]() ,由Fe元素守恒可知反应生成Fe(NO3)3,该反应方程式为:10Fe+36HNO3 =10Fe(NO3)3+3N2↑+18H2O,故答案为:N2; Fe3+ ;10Fe+36HNO3 =10Fe(NO3)3+3N2↑+18H2O。
,由Fe元素守恒可知反应生成Fe(NO3)3,该反应方程式为:10Fe+36HNO3 =10Fe(NO3)3+3N2↑+18H2O,故答案为:N2; Fe3+ ;10Fe+36HNO3 =10Fe(NO3)3+3N2↑+18H2O。


科目:高中化学 来源: 题型:
【题目】某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿,提取锌、铜元素,实现废物综合利用,方案如图所示:
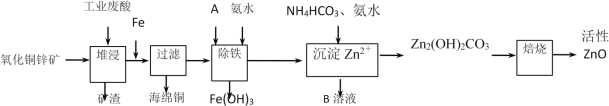
已知:各离子开始沉淀及完全沉淀时的pH如表所示。
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 6.34 | 9.7 |
Fe3+ | 1.48 | 3.2 |
Zn2+ | 6.2 | 8.0 |
请回答下列问题:
(1)加入A物质的目的是___,物质A可使用下列物质中的___。
A.KMnO4 B.O2 C.H2O2 D.Cl2
(2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)___Ksp(ZnS)(选填“>”“<”或“=”)。
(3)反应生成海绵铜的离子方程式:___。
(4)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在___范围之间。
(5)写出NH4HCO3溶液与Zn2+反应生成Zn2(OH)2CO3的离子方程式:___。
(6)物质B可用作生产化肥,其化学式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.已知t℃时,MgCO3的Ksp=4×10-6,则MgCO3饱和溶液中含Mg2+数目为2×10-3NA
B.一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数一定为0.1NA
C.CO2通过Na2O2使其增重bg时,反应中转移的电子数为![]()
D.1mol带有乙基支链的烷烃,分子中所含碳原子数最少为5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学式为C2H6O的化合物A具有如下性质:A+Na―→慢慢产生气泡
A+CH3COOH![]() 有香味的产物
有香味的产物
(1)根据上述信息,对该化合物可作出的判断是(____)。
A.一定含有—OH B.一定含有—COOH
C.A为乙醇 D.A为乙醛
(2)含A的体积分数为75%的水溶液可以用作______。
(3)A与钠反应的化学方程式:_____________。
(4)化合物A与CH3COOH反应生成的有香味的产物的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不属于盐类水解应用的是( )
A.明矾、氯化铁晶体常用于净水
B.实验室通常在HCl气氛中加热MgCl2·6H2O制MgCl2
C.实验室配制FeCl3溶液时加入少量稀盐酸
D.实验室制氢气时加入CuSO4可加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
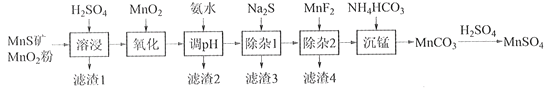
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnz2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___________。
时,z=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在可逆反应2A(g)+3B(g)![]() xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。则关于此反应的下列说法中正确的是( )
xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。则关于此反应的下列说法中正确的是( )
A.2 min末时A和B的浓度之比为5∶3
B.x=1
C.2 min末时B的浓度为1.5 mol·L-1
D.2 min末时A的消耗浓度为0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯是一种重要的化工原料,也是一种重要的溶剂。请回答下列问题:
⑴把苯加入到盛有溴水的试管中,液体会出现分层现象,充分振荡、静置,出现橙红色液体的一层在_______层(填“上”或“下”);
⑵把苯加入到盛有少量高锰酸钾溶液的试管中,振荡后,酸性高锰酸钾溶液不褪色,说明苯分子中________(填“有”或“没有”)碳碳双键;
⑶在浓硫酸作用下,苯在50~60℃可以与浓硝酸反应生成硝基苯,反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为某同学设计的检验浓硫酸和碳反应所得气体产物的实验装置图。下列说法正确的是

A. 若按①→③→②顺序连接,可检验所有气体产物
B. 若装置②只保留a、b,同样可以达到实验目的
C. 若圆底绕瓶内碳粉过量,充分反应后恢复到25℃,溶液的pH≥5.6
D. 实验结束后,应按从下往上、从左往右的顺序拆卸装置
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com