
【题目】(1)下列元素或化合物的性质变化顺序正确的是__________________
A.第一电离能:Cl>S>P>Si
B.共价键的极性:HF>HCl>HBr>HI
C.晶格能:NaF>NaCl>NaBr>NaI
D.热稳定性:MgCO3>CaCO3>SrCO3>BaCO3
(2)FeCl3 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的 FeCl3 的结构式为_________,其中 Fe 的配位数为___________________
(3)NH4H2PO4 中,电负性最高的元素是________;P的________________杂化轨道与 O的2p轨道形成______键。NH4H2PO4 和 LiFePO4 属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐, 如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示。这类磷酸根离子的化学式可用通式表示为 ______________(用 n 代表 P 原子数)。
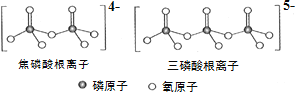
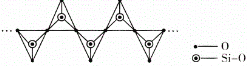
(4)高温高压下 CO2 的晶体结构与SiO2 相似,该晶体熔点比 SiO2 晶体____________(填“高”或“低”)。硅酸盐和 SiO2 一样,都是以硅氧四面体作为基本结构单元,图中表示一种含 n 个硅原子的单链式多硅酸根的结构(投影如图),Si 原子的杂化类型为_______________,其化学通式可表示为____________________
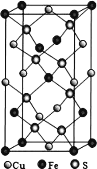
(5)四方晶系 CuFeS2 晶胞结构如图所示(下一页)。Cu2+的配位数为_______________,S2-的配位数为__已知:a=b=0.524 nm,c=1.032 nm,NA 为阿伏加德罗常数的值,CuFeS2晶体的密度是_________________ gcm-3(列出计算式)。
【答案】BC ![]() 4 O sp3 σ (PnO3n+1)(n+2)- 高 sp3 (SiO3)n 2n- 4 4
4 O sp3 σ (PnO3n+1)(n+2)- 高 sp3 (SiO3)n 2n- 4 4 ![]()
【解析】
(1)A.第一电离能,一般与非金属性成正比,当电子亚层处于半满、全满时出现反常;
B.对于氢化物分子,非金属性越强,键的极性越强;
C.晶格能与离子的带电荷成正比,与离子半径的平方成反比;
D.热稳定性与分解产物的稳定性有关。
(2)蒸汽状态下以双聚分子存在的 FeCl3 的结构式与Al2Cl6类似,由结构可确定 Fe 的配位数。
(3)NH4H2PO4 中,电负性最高的元素也就是非金属性最强的元素;P与周围的4个O原子相连,价层电子对数为4,从而确定与 O的2p轨道形成的键型。由两个已知结构式寻找规律,得出图中磷酸根离子的化学式通式。
(4)比较原子晶体熔点,可比较原子半径,半径越小,熔点越高。图中表示一种含 n 个硅原子的单链式多硅酸根的结构,Si 原子的价层电子对数为4,由此确定杂化类型,确定化学通式时,可采用均摊法。
(5)Cu2+位于面心,有2个S2-与它相连;1个S2-与2个Cu2+、2个Fe2+相连。已知:a=b=0.524 nm,c=1.032 nm,可求出体积,NA 为阿伏加德罗常数的值,求CuFeS2晶体的密度,只需求出1个晶胞中所含离子的数目。
(1)A.由于P原子的3p轨道半充满,第一电离能出现反常,所以第一电离能:Cl>P>S>Si,A不正确;
B.对于氢化物分子,非金属性越强,键的极性越强,所以共价键的极性:HF>HCl>HBr>HI,B正确;
C.晶格能与离子的带电荷成正比,与离子半径的平方成反比,所以晶格能:NaF>NaCl>NaBr>NaI,C正确;
D.对于同主族元素的碳酸盐,金属性越强,其氧化物越稳定,碳酸盐的热稳定性越差,所以热稳定性:MgCO3<CaCO3<SrCO3<BaCO3,D不正确;
故选BC。答案为:BC;
(2)FeCl3蒸汽状态下以双聚分子存在,则类似于Al2Cl6,即每个Fe与4个Cl形成共价键,其中有1个是配位键,从而得出FeCl3 的结构式为![]() ,其中 Fe 的配位数为4。答案为:
,其中 Fe 的配位数为4。答案为:![]() ;4;
;4;
(3)NH4H2PO4 中,电负性最高的元素是O;P与周围的4个O原子相连,价层电子对数为4,所以P的sp3杂化轨道与 O的2p轨道形成σ键。分析磷酸根离子中P、O原子个数的递变规律,可得出其化学式可用通式表示为(PnO3n+1)(n+2)-。答案为:O;sp3;σ;(PnO3n+1)(n+2)-;
(4)高温高压下 CO2 的晶体结构与SiO2 相似,也为原子晶体。比较原子晶体熔点时,可比较原子半径,半径越小,熔点越高,所以该晶体熔点比 SiO2 晶体高。从一种含 n 个硅原子的单链式多硅酸根的结构图中可以看出,每个Si与4个O相连,所以Si 原子的杂化类型为sp3,在每个结构单元中,有1个Si、4个O,其中有2个O完全属于此结构单元,有2个O被两个结构单元共用,从而得出其化学通式可表示为(SiO3)n 2n-。答案为:高;sp3;(SiO3)n 2n-;
(5)由晶胞结构分析可知,面心上的Cu2+与2个S2-相连,晶胞中每个Cu2+与4个S2-相连,Cu2+的配位数为4;1个S2-与2个Cu2+、2个Fe2+相连,则每个S2-的配位数为4。晶胞中,Fe2+数为8×![]() +4×
+4×![]() +1=4,Cu2+数为6×
+1=4,Cu2+数为6×![]() +4×
+4×![]() =4,S2-数为8,晶胞内共含4个CuFeS2,a=b=0.524 nm,c=1.032 nm,NA 为阿伏加德罗常数的值,CuFeS2晶体的密度是
=4,S2-数为8,晶胞内共含4个CuFeS2,a=b=0.524 nm,c=1.032 nm,NA 为阿伏加德罗常数的值,CuFeS2晶体的密度是![]() gcm-3。答案为:4;4;
gcm-3。答案为:4;4;![]() 。
。


科目:高中化学 来源: 题型:
【题目】孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备CuSO4·5H2O,主要步骤如下:
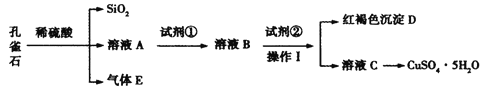
已知该条件下,通过调节溶液的酸碱性而使 Fe3+、Fe2+、Cu2+生成沉淀的 pH 分别如下:
物质 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe(OH)3 | 2.2 | 3.2 |
Fe(OH)2 | 7.6 | 9.6 |
Cu(OH)2 | 4.7 | 6.4 |
请回答下列问题:
(1)为了提高孔雀石酸浸时的速率,除适当增加浓硫酸浓度外,还可以采取的措施有:___(写一种)。
(2)试剂①是双氧水,把 Fe2+氧化成 Fe3+的目的是___。根据如图有关数据,你认为工业上氧化操作时应采取的条件是___。
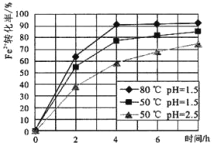
(3)试剂②为CuO,其目的是调节溶液的 pH 保持在___范围。操作Ⅰ的名称是___。
(4)溶液 C 得到CuSO4·5H2O的主要步骤是___、___、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属及其化合物的不合理的是( )
A. 将废铁屑加入![]() 溶液中,可用于除去工业废气中的
溶液中,可用于除去工业废气中的![]()
B. 铝中添加适量钾,制得低密度、高强度的铝合金,可用于航空工业
C. 盐碱地(含较多![]() 等)不利于作物生长,可施加熟石灰进行改良
等)不利于作物生长,可施加熟石灰进行改良
D. 无水![]() 呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
查看答案和解析>>
科目:高中化学 来源: 题型:
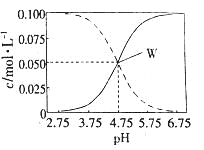
【题目】室温条件下在醋酸、醋酸钠混合溶液中,当c(CH3COOH)+c(CH3COO-)=0.lmol.L-1时,c(CH3COOH)、
c(CH3COO-)与pH的关系如图所示。下列有关叙述正确的是
 [
[
A.pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)+c(OH-)
B.向W点所表示的1.0L溶液中通人0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-)
C.pH=3.5的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol.L-l
D.W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH)-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。

(1)收集到(CH3)4NOH的区域是________(填a、b、c或d)。
(2)写出电池总反应_____________。
(二)乙酸乙酯一般通过乙酸和乙醇酯化合成:CH3COOH(l)+C2H5OH(l) ![]() CH3COOC2H5(l)+H2O(l) ΔH=-2.7kJ·mol-1
CH3COOC2H5(l)+H2O(l) ΔH=-2.7kJ·mol-1
已知纯物质和相关恒沸混合物的常压沸点如下表:
纯物质 | 沸点/℃ | 恒沸混合物(质量分数) | 沸点/℃ |
乙醇 | 78.3 | 乙酸乙酯(0.92)+水(0.08) | 70.4 |
乙酸 | 117.9 | 乙酸乙酯(0.69)+乙醇(0.31) | 71.8 |
乙酸乙酯 | 77.1 | 乙酸乙酯(0.83)+乙醇(0.08) +水(0.09) | 70.2 |
请完成:
(1)关于该反应,下列说法不合理的是_____________。
A.反应体系中硫酸有催化作用
B.因为化学方程式前后物质的化学计量数之和相等,所以反应的ΔS等于零
C.因为反应的△H 接近于零,所以温度变化对平衡转化率的影响大
D.因为反应前后都是液态物质,所以压强变化对化学平衡的影响可忽略不计
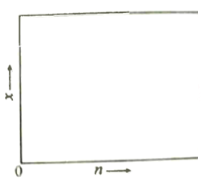
(2)一定温度下该反应的平衡常数K=4.0。若按化学方程式中乙酸和乙醇的化学计量数比例投料,则乙酸乙酯的平衡产率y =_________;若乙酸和乙醇的物质的量之比为n : 1,相应平衡体系中乙酸乙酯的物质的量分数为x,请在图中绘制x随n变化的示意图(计算时不计副反应)________。
(3)工业上多采用乙酸过量的方法,将合成塔中乙酸、乙醇和硫酸混合液加热至110℃左右发生酯化反应并回流,直到塔顶温度达到70~71℃,开始从塔顶出料。控制乙酸过量的作用有___________________。
(4)近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:2C2H5OH(g) ![]() CH3COOC2H5(g)+2H2(g)
CH3COOC2H5(g)+2H2(g)
在常压下反应,冷凝收集,测得常温下液体收集物中主要产物的质量分数如图所示。关于该方法,下列推测合理的是_____。
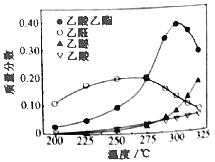
A.反应温度不宜超过300℃
B.增大体系压强,有利于提高乙醇平衡转化率
C.在催化剂作用下,乙醛是反应历程中的中间产物
D.提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫酸渣(含Fe2O3、SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如下:
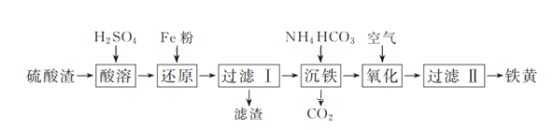
(1)“酸溶”中加快溶解的方法为____(写出一种)。
(2)“还原”过程中的离子方程式为_______。
(3)①“沉铁”过程中生成Fe(OH)2的化学方程式为_______。②若用CaCO3“沉铁”,则生成FeCO3沉淀。当反应完成时,溶液中c(Ca2+)/c(Fe2+)=________。[已知Ksp(CaCO3)=2.8×10-9,Ksp(FeCO3)=2×10-11]
(4)“氧化”时,用NaNO2浓溶液代替空气氧化Fe(OH)2浆液,能缩短氧化时间,但缺点是_________。
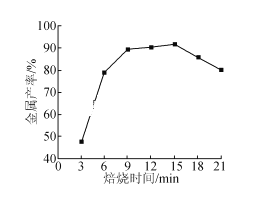
(5)焦炭还原硫酸渣炼铁能充分利用铁资源,在1225℃、n(C)/n(O)=1.2时,焙烧时间与金属产率的关系如图,时间超过15min金属产率下降的原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计如图所示装置,用CuCl2·2H2O晶体和SOCl2获取无水CuCl2并回收过量的SOCl2。
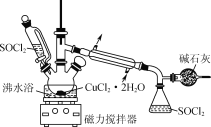
已知:SOCl2的熔点为-105℃,沸点为76℃,遇水剧烈反应生成两种酸性气体。
回答下列问题:
(1)CuCl2·2H2O晶体和SOCl2发生反应的化学方程式是___。
(2)碱石灰除了能吸收SO2、HCl等酸性气体,还能起到的作用为__。
(3)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,操作步骤如下:
步骤1:取0.2500g试样溶于水,加入过量KI固体充分反应,生成白色CuI沉淀。
步骤2:滴入几滴淀粉溶液。
步骤3:再滴入0.1000mol·L-1Na2S2O3溶液,发生的反应为2S2O32-+I2=S4O62-+2I-,恰好完全反应时,消耗Na2S2O3溶液18.00mL。
①恰好完全反应时的实验现象为__。
②计算试样中铜元素的质量分数__(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(![]() )是一种重要的化工试剂,实验室合成硫酰氯的实验装置如下图所示:
)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如下图所示:
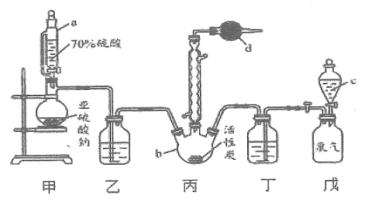
已知:①![]() ,
,![]()
②硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中易“发烟”;
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
(1)仪器c的名称为_____,与c相比,仪器a的优点是__________。
(2)装置乙和丁中所装的试剂为_________________。
(3)球形冷凝管的作用___________________。
A.导气、冷凝回流 B.有利于平衡正向移动 C.防倒吸
(4)仪器d的作用为______________________。
(5)氯磺酸(![]() )加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为_________________________。
)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为_________________________。
(6)当装置戊中排出氯气![]() (已折算成标准状况)时,最终得到
(已折算成标准状况)时,最终得到![]() 纯净的硫酰氯,则硫酰氯的产率为____________。(保留三位有效数字)
纯净的硫酰氯,则硫酰氯的产率为____________。(保留三位有效数字)
(7)长期存放的硫酰氯会发黄,其原因可能为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铵是一种传统的氮肥,某种制取硫酸铵的流程如下:
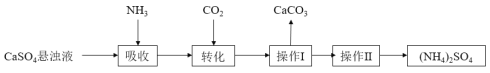
请回答下列问题:
(1)操作Ⅰ的名称为_________。
(2)在CaSO4悬浊液中通入NH3、CO2生成(NH4)2SO4的化学方程式________________。
(3)为测定硫酸铵的纯度,称取3.000g样品,溶于水,依次加入足量稀盐酸和足量BaCl2溶液,充分反应,过滤,沉淀经洗涤后烘干至恒重,得到4.660 g BaSO4。该硫酸铵的纯度为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com