
����Ŀ��ij��ѧ��ȤС�������ͼ��ʾװ�ã���CuCl2��2H2O�����SOCl2��ȡ��ˮCuCl2�����չ�����SOCl2��
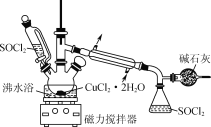
��֪��SOCl2���۵�Ϊ��105�棬�е�Ϊ76�棬��ˮ���ҷ�Ӧ���������������塣
�ش��������⣺
��1��CuCl2��2H2O�����SOCl2������Ӧ�Ļ�ѧ����ʽ��___��
��2����ʯ�ҳ���������SO2��HCl���������壬����������Ϊ__��
��3��ijͬѧ������ӵ��������ⶨ��ˮCuCl2��Ʒ��ͭԪ�صİٷֺ����������������£�
����1��ȡ0.2500g��������ˮ���������KI�����ַ�Ӧ�����ɰ�ɫCuI������
����2�����뼸�ε�����Һ��
����3���ٵ���0.1000mol��L-1Na2S2O3��Һ�������ķ�ӦΪ2S2O32-��I2=S4O62-��2I-��ǡ����ȫ��Ӧʱ������Na2S2O3��Һ18.00mL��
��ǡ����ȫ��Ӧʱ��ʵ������Ϊ__��
�ڼ���������ͭԪ�ص���������__(д���������)��
���𰸡�CuCl2��2H2O��2SOCl2=CuCl2��2SO2����4HCl�� ��ֹ������ˮ����������ƿ����SOCl2������Ӧ ��Һ����ɫ��Ϊ��ɫ 46.1%
��������
��SOCl2Һ����뵽CuCl2��2H2O�����У�������Ӧ����CuCl2���������SOCl2�����ȥ��������������ƿ�н��ܣ�ע���ֹSOCl2��ˮ���ҷ�Ӧ�����Ҫ�ü�ʯ�ҷ�ֹ������ˮ�������뵽��ƿ�С�
��SOCl2��ˮ���ҷ�Ӧ���������������壬���CuCl2��2H2O�����SOCl2������Ӧ�Ļ�ѧ����ʽ��CuCl2��2H2O��2SOCl2=CuCl2��2SO2����4HCl�����ʴ�Ϊ��CuCl2��2H2O��2SOCl2 = CuCl2��2SO2����4HCl����
�Ƽ�ʯ�ҳ���������SO2��HCl���������壬����SOCl2��ˮ���ҷ�Ӧ����˼�ʯ�һ���������Ϊ��ֹ������ˮ����������ƿ����SOCl2������Ӧ���ʴ�Ϊ����ֹ������ˮ����������ƿ����SOCl2������Ӧ��
������ʼ�еⵥ�ʣ���������Ӧ�꣬���ǡ����ȫ��Ӧʱ��ʵ������Ϊ��Һ����ɫ��Ϊ��ɫ���ʴ�Ϊ����Һ����ɫ��Ϊ��ɫ��
�����ݷ�Ӧ����ʽ�õ���ϵʽ2Cu2+ �� I2 �� 2S2O32��n(Na2S2O3) = n(Cu2+) = 0.1000mol��L1��0.018L = 0.0018mol��![]() ���ʴ�Ϊ46.1%��
���ʴ�Ϊ46.1%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪25��ʱ���������ܵ���ʵ��ܶȻ�����Ksp���±���ʾ(��ij������Ũ����10-5mol��L-1ʱ����Ϊ��ȫ����)��
![]()

����˵����ȷ���ǣ� ��
A.��ͬ�¶��£��ܶȻ�����Խ����Ӧ���ʵ��ܽ�Ⱦ�Խ��
B.����1LNaCl��Һ��0.01molAgBrת��ΪAgCl��������c(NaCl)��3.61mol/L
C.�ڱ���Ag2CrO4��Һ�м���K2CrO4��ʹ��Һ��ͼ��Y���ΪX��
D.AgCl����Һ�д���ƽ�⣺AgCl(s)![]() Ag+(aq)+Cl-(aq)�������м�������NaCl���壬ƽ�������ƶ�����Һ�����ӵ���Ũ�Ȼ��С
Ag+(aq)+Cl-(aq)�������м�������NaCl���壬ƽ�������ƶ�����Һ�����ӵ���Ũ�Ȼ��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ƣ�Na2S2O4���׳Ʊ��շۣ��ױ�����������������ͼװ�ã�����ƿ�м���HCOONa��NaOH��CH3OH ��ˮ�γɵĻ��Һ��ͨ�� SO2 ʱ������Ӧ���ɱ��շۺ�һ�ֳ������壬����˵��������ǣ� ��
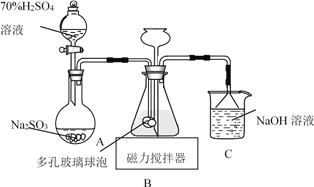
A.�Ʊ����շ۵����ӷ���ʽΪ��HCOO����OH����2SO2=S2O42-+CO2����H2O
B.��ײ������ݵ�������������������Һ�ĽӴ������ʹ SO2 �ܱ��������
C.NaOH ��Һ����Ҫ�����������ݳ���CO2
D.Ϊ���� Na2S2O4 �� O2 ������ʹ���������������ȷ�Ӧ�������� SO2 �ų�װ���е� O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)����Ԫ�ػ�������ʱ仯˳����ȷ����__________________
A����һ�����ܣ�Cl��S��P��Si
B�����ۼ��ļ��ԣ�HF��HCl��HBr��HI
C�������ܣ�NaF��NaCl��NaBr��NaI
D�����ȶ��ԣ�MgCO3��CaCO3��SrCO3��BaCO3
(2)FeCl3 �еĻ�ѧ���������ԵĹ����ԣ�����״̬����˫�۷��Ӵ��ڵ� FeCl3 �ĽṹʽΪ_________������ Fe ����λ��Ϊ___________________
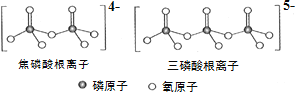
(3)NH4H2PO4 �У��縺����ߵ�Ԫ����________��P��________________�ӻ������ O��2p����γ�______����NH4H2PO4 �� LiFePO4 ���ڼ������Σ���ֱ���Ķ�����������һ�ָ��������Σ� �磺�������ơ��������Ƶȡ�����������ӡ����������������ͼ��ʾ��������������ӵĻ�ѧʽ����ͨʽ��ʾΪ ______________���� n ���� P ԭ��������
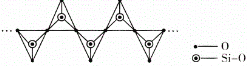
(4)���¸�ѹ�� CO2 �ľ���ṹ��SiO2 ���ƣ��þ����۵�� SiO2 ����____________���������������������������κ� SiO2 һ���������Թ�����������Ϊ�����ṹ��Ԫ��ͼ�б�ʾһ�ֺ� n ����ԭ�ӵĵ���ʽ�������Ľṹ��ͶӰ��ͼ����Si ԭ�ӵ��ӻ�����Ϊ_______________���仯ѧͨʽ�ɱ�ʾΪ____________________
(5)�ķ���ϵ CuFeS2 �����ṹ��ͼ��ʾ����һҳ����Cu2������λ��Ϊ_______________��S2-����λ��Ϊ__��֪��a��b��0.524 nm��c��1.032 nm��NA Ϊ�����ӵ�������ֵ��CuFeS2������ܶ���_________________ gcm-3(�г�����ʽ)��
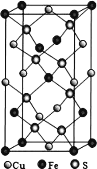
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25�桢101kPa�£�̼������������������ǵ�ȼ����������393.5kJ/mol��285.8kJ/mol��890.3kJ/mol��2800kJ/mol���������Ȼ�ѧ����ʽ��ȷ����
A.C��s��+![]() O2��g����CO��g�� ��H=-393.5kJ/mol
O2��g����CO��g�� ��H=-393.5kJ/mol
B.2H2��g��+O2��g����2H2O��l�� ��H =+571.6kJ/mol
C.CH4��g��+2O2��g���� CO2��g��+2H2O��g�� ��H=-890.3kJ/mol
D.C6H12O6��s��+6O2��g����6CO2��g��+6H2O��l�� ��H=-2800kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ����0.1000mol/LKOH��Һ�ζ�δ֪Ũ�ȵ�������Һ��������ɷ�Ϊ���¼�����
(A)��ȡ20.00mL�����������Һע��ྻ����ƿ��������2-3�η�̪
(B)�ñ���Һ��ϴ�ζ���2-3��
(C)��ʢ��KOH����Һ�ļ�ʽ�ζ��̶ܹ��ã�����Һ��ʹ�ζ��ܼ��������Һ
(D)ȡ����Һע���ʽ�ζ�����0�̶�����2-3cm
(E)����Һ����0��0�̶����£����¶���
(F)����ƿ���ڵζ��ܵ����棬�ñ�KOH��Һ�ζ����յ㣬���µζ���Һ��Ŀ̶�
���������գ�
��1����ȷ������˳����(�������ĸ��д)B��__��__��__��__��F��
��2������(B)������Ŀ����___��
��3���жϵζ������յ��������___��
��4�����ζ���ʼ�ͽ���ʱ����ʽ�ζ����е�Һ����ͼ��ʾ������ʼ����Ϊ__mL���յ����Ϊ___mL������������Һ��Ũ��Ϊ___mol/L��

��5�����ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�������������ȷ����Եζ����������Ӱ����__������ȡһ������KOH����(������NaOH)���Ʊ���Һ�������ζ��������ᣬ��Եζ����������Ӱ����___��(����ƫ��������ƫ������������Ӱ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ȡ﮺�﮵Ļ������ԭ�ϣ��õ�ⷨ�Ʊ�������﮵Ĺ���ԭ����ͼ��ʾ������������ȷ����( )
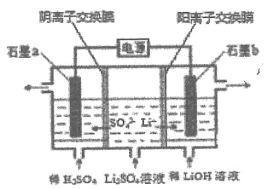
A.![]() ��������Һ��
��������Һ��![]() ����
����
B.![]() �������ķ�ӦΪ
�������ķ�ӦΪ![]()
C.�÷��Ʊ�![]() ���ɵõ����ᡢ����������
���ɵõ����ᡢ����������
D.����·��ͨ��![]() ����ʱ���ɵõ�
����ʱ���ɵõ�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʪ����п�ĵ��Һ��ͬʱ����Cu��CuSO4��������CuCl������ȥCl�������ͶԵ���Ӱ�죬��Ӧԭ�����£�
Cu(s)+Cu2+(aq)![]() 2Cu+(aq) ��H1��a kJ��mol-1
2Cu+(aq) ��H1��a kJ��mol-1
Cl��(aq)+Cu+(aq)![]() CuCl(s) ��H2��b kJ��mol-1
CuCl(s) ��H2��b kJ��mol-1
ʵ���õ��ҺpH����Һ�в���c(Cl��)��Ӱ����ͼ��ʾ������˵����ȷ����

A. ��ҺpHԽ����Ksp(CuCl)����
B. ����Һ�м���ϡ���ᣬ������Cl-��ȥ��
C. ��Ӧ�ﵽƽ������c(Cu2+)��c(Cl��)��С
D. ![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl��(aq)
Cu2+(aq)+Cl��(aq)![]() CuCl(s)����H��(a+2b) kJ��mol-1
CuCl(s)����H��(a+2b) kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС������ͼ��ʾװ������Կ���϶�ͭ������˵��������ǣ� ��
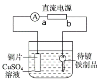
A.��Կ��������B.aΪ��Դ������
C.ͨ�����Һ��SO42-��������D.ͭƬ�ϵķ�ӦʽΪCu-2e-=Cu2+
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com