
 ;
; ;O2-;Na+;第三周期第VIA族;
;O2-;Na+;第三周期第VIA族;
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
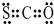
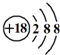

20 17 |
| A、①④⑤ | B、②③④⑥ |
| C、③⑤⑥⑦ | D、全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③②①⑤④ |
| B、③①②⑤④ |
| C、②③①⑤④ |
| D、③①⑤②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 测定溶液的pH | ||||
| 加入碱溶液的体积/mL | 甲 | 乙 | 丙 | 丁 |
| 19.98 | 4.3 | 7.7 | 4.3 | |
| 20.00 | 7.0 | 7.0 | 8.7 | 5.3 |
| 20.02 | 9.7 | 10.0 |
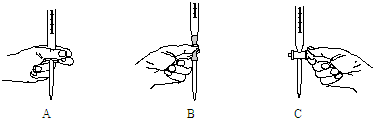
| 甲 | 丙 | |
| 建议选用的指示剂 | | |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH溶液 |
| Cu/Ag |
| △ |
| ①HCN/OH- |
| ②H2O/H+△ |
乳酸 C3H6O3 |
| 浓H2SO4 |
| △ |
| 一定条件 |
F 加聚物 |
| ①HCN/OH- |
| ②H2O/H+△ |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 适应条件 |
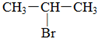 ;1mol某烃A充分燃烧后可以得到8mol CO2和4mol H2O.该烃A在不同条件下能发生如图所示的一系列变化.
;1mol某烃A充分燃烧后可以得到8mol CO2和4mol H2O.该烃A在不同条件下能发生如图所示的一系列变化.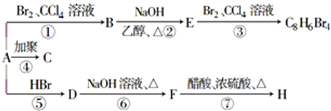
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com