
| 测定溶液的pH | ||||
| 加入碱溶液的体积/mL | 甲 | 乙 | 丙 | 丁 |
| 19.98 | 4.3 | 7.7 | 4.3 | |
| 20.00 | 7.0 | 7.0 | 8.7 | 5.3 |
| 20.02 | 9.7 | 10.0 |
| 甲 | 丙 | |
| 建议选用的指示剂 | | |
| 0.1mol?L-1×2×10-5L |
| 0.04L |


科目:高中化学 来源: 题型:
| A、1L 1mol?L-1的NH4NO3溶液中氮原子数小于2NA |
| B、常温常压下,11.2g乙烯中含有共用电子对数目为2.4NA |
| C、在O2参加的反应中,1molO2作氧化剂时得到的电子数一定是4NA |
| D、标准状况下,22.4LCCl4中所含有的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| J | ||||
| R |
| 选项 | a | b | c | d |
| x | 温度 | 湿度 | 加入氧气 | 加入乙物质 |
| y | 乙的物质的量 | 平衡常数K | 乙的转化率 | 生成物物质的量总和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相对分子质量相同的物质是同种物质 |
| B、赤潮发生的根本原因是含氟制冷剂大量使用导致臭氧层破坏的结果 |
| C、具有同一通式的物质属于同系物 |
| D、含氮、磷的大量污水直接排入大海,是赤潮发生的直接原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
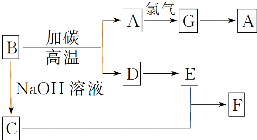 如图是常见物质之间的转化,其中A是芯片的主要成分,其对应的单质的结构与金刚石的结构是相似的,D、E外均含有A的元素.
如图是常见物质之间的转化,其中A是芯片的主要成分,其对应的单质的结构与金刚石的结构是相似的,D、E外均含有A的元素.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com