
| 5 |
| 2 |
| 2.25×10 -3×239 |
| 0.6000 |


科目:高中化学 来源: 题型:
| A、加入催化剂,改变了反应的途径,反应的△H也随之改变 |
| B、改变压强,平衡不发生移动,反应放出的热量不变 |
| C、升高温度,反应速率加快,反应放出的热量不变 |
| D、若在原电池中进行,反应放出的热量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 测定溶液的pH | ||||
| 加入碱溶液的体积/mL | 甲 | 乙 | 丙 | 丁 |
| 19.98 | 4.3 | 7.7 | 4.3 | |
| 20.00 | 7.0 | 7.0 | 8.7 | 5.3 |
| 20.02 | 9.7 | 10.0 |
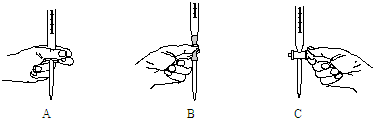
| 甲 | 丙 | |
| 建议选用的指示剂 | | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH溶液 |
| Cu/Ag |
| △ |
| ①HCN/OH- |
| ②H2O/H+△ |
乳酸 C3H6O3 |
| 浓H2SO4 |
| △ |
| 一定条件 |
F 加聚物 |
| ①HCN/OH- |
| ②H2O/H+△ |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
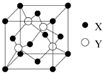 元素X位于第四周期,其基态原子的内层轨道全部排满电子,最外层电子数为2.元素Y基态原子的3p轨道有4个电子.元素Z的原子最外层电子数是内层的3倍.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,最外层电子数为2.元素Y基态原子的3p轨道有4个电子.元素Z的原子最外层电子数是内层的3倍.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol?L-1,请回答下列问题:
(1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol?L-1,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| C |
| D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com