
 (1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol?L-1,请回答下列问题:
(1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol?L-1,请回答下列问题:| 0.6mol/L |
| 10s |
| 1 |
| 2 |
| 1.2mol |
| 4mol |


 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
| J | ||||
| R |
| 选项 | a | b | c | d |
| x | 温度 | 湿度 | 加入氧气 | 加入乙物质 |
| y | 乙的物质的量 | 平衡常数K | 乙的转化率 | 生成物物质的量总和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
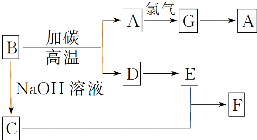 如图是常见物质之间的转化,其中A是芯片的主要成分,其对应的单质的结构与金刚石的结构是相似的,D、E外均含有A的元素.
如图是常见物质之间的转化,其中A是芯片的主要成分,其对应的单质的结构与金刚石的结构是相似的,D、E外均含有A的元素.查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
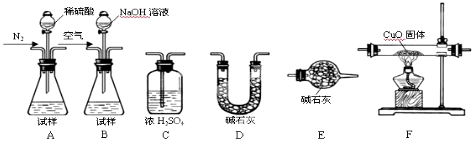
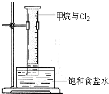
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,当有1 mol铜被氧化时,被还原的硝酸为23 mol |
| B、某溶液100 mL,其中含硫酸0.03 mol,硝酸0.04 mol,若在该溶液中投入1.92 g铜粉微热,反应后放出一氧化氮气体约为0.015 mol |
| C、室温时,在容积为a mL的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入b mL O2,则管内液面又继续上升,测得试管内最后剩余气体为c mL,且该气体不能支持燃烧.则a、b的关系为 a=4b+3c |
| D、物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比为1:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com