
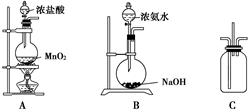
 (2分)
(2分) 。
。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源:不详 题型:单选题
| A.将乙酸和乙醇混合加热制乙酸乙酯 |
| B.用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热 |
| C.CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型 |
| D.苯和浓溴水反应制溴苯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
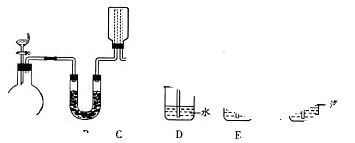
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
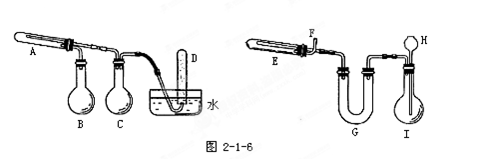
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.配制一定体积的物质的量浓度溶液,定容时仰视,会使浓度偏低 |
| B.盛装水玻璃和氢氧化钠溶液的试剂瓶,都不能使用磨口玻璃塞 |
| C.向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有吸水性 |
| D.常温下,浓硝酸可用铝罐来贮存,说明浓硝酸具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 应称量盐酸体积/mL | 应选用容量瓶的规格/mL | 除容量瓶外还需的其它仪器 |
| | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
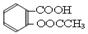 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下: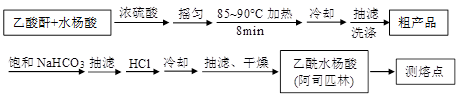
| 名 称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
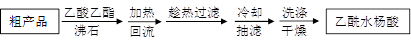 改进的提纯方法中加热回流的装置如图所示
改进的提纯方法中加热回流的装置如图所示
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
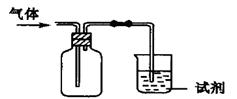
| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | 氯水有酸性和漂白性 |
| B | NH3 | 水 | 无明显现象 | NH3能溶于水 |
| C | X | 澄清石灰水 | 溶液变浑浊 | 气体可能是CO2 |
| D | SO2 | 酸性KMnO4(aq) | 溶液褪色 | SO2有漂白性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com