
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是
A.气态氢化物的稳定性:H2O>NH3>SiH4
B.氢元素与其他元素可形成共价化合物或离子化合物
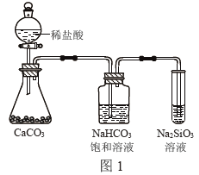
C.图1所示实验可证明元素的非金属性:Cl>C>Si
D.用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
科目:高中化学 来源: 题型:
【题目】在下列反应中,HCl作还原剂的是( )
A. NaOH + HCl = NaCl + H2O
B. Zn + 2HCl = ZnCl2 + H2↑
C. MnO2 + 4HCl(浓)![]() MnCl2 + 2H2O + Cl2↑
MnCl2 + 2H2O + Cl2↑
D. CuO + 2HCl = CuCl2 + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
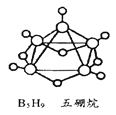
【题目】(1)2008年北京奥运会主体育场的外形好似“鸟巢”(The Bird Nest),有一类化学物质也好似鸟巢,如化学式是B5H9的五硼烷(如图)。 请问五硼烷的摩尔质量是____g/mol。

(2)在同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为______,质量之比为______,密度之比为________。
现有三组混合物:①溴水 ②39%的乙醇溶液(乙醇的沸点为78.4℃)③汽油和氯化钠溶液,分离以上各混合物的正确实验方法依次是_______ 、________、_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题。
Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:
H2S+Fe2(SO4)3![]() S↓+2FeSO4+H2SO4
S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
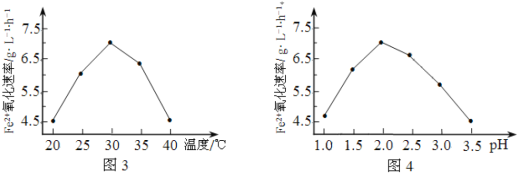
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是______________。
(2)由图3和图4判断使用硫杆菌的最佳条件为______________。若反应温度过高,反应速率下降,其原因是______________。
方法2:在一定条件下,用H2O2氧化H2S
(3)随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物的分子式为__________。
Ⅱ.SO2的除去
方法1(双碱法):用NaOH吸收SO2,并用CaO使NaOH再生
NaOH溶液![]() Na2SO3
Na2SO3
(4)写出过程①的离子方程式:____________________________;CaO在水中存在如下转化:
CaO(s)+H2O (l) ![]() Ca(OH)2(s)
Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq)
Ca2+(aq)+2OH(aq)
从平衡移动的角度,简述过程②NaOH再生的原理____________________________________。
方法2:用氨水除去SO2
(5)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L-1,溶液中的c(OH)=_________________mol·L1。将SO2通入该氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=___________________。
)=___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某同学采用如右图所示装置进行铜与硝酸的反应的实验。已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有3.2 g铜。

①请写出铜与浓硝酸反应的离子反应方程式_______________________________
②待试管b中的反应充分完成后,冷却至室温,再向b中的液体加入足量的氢氧化钠溶液,将生成的沉淀过滤洗涤干燥并加强热至质量不再改变,所得固体的质量为_______g。
Ⅱ.某中学化学研究性学习小组利用加热氯化铵和熟石灰混合物并按以下装置制取、探究氨气的性质。
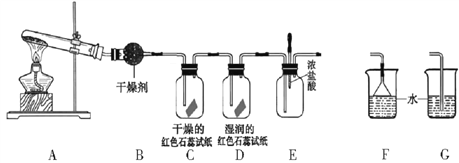
(1)实验室收集氨气的方法是____________________
(2)C、D装置中颜色会发生变化的是__________(填“C”或“D”)
(3)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1-2滴浓盐酸,可观察到的现象是__________________________
(4)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是__________(填“F”或“G”)。
(5)生石灰与水作用放出热量。实验室利用此原理,往生石灰中滴加浓氨水,可以快速制取氨气。你认为生石灰可用下列__________物质代替(填序号)。
A.碱石灰(NaOH和CaO的固体混合物) B.NaCl 固体
C.硫酸溶液 D.石灰石(含CaCO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓硫酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
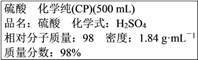
(1)通过计算可知,上述浓硫酸中H2SO4的物质的量浓度为__________molL-1。
实验室需要240 mL 2.0 mol·L-1的H2SO4溶液,现用以上浓硫酸配制,请回答下列问题:
(2)下列仪器中,不会用到的是________。
A.50 mL量筒 B.100 mL容量瓶 C.玻璃棒 D.托盘天平 E.药匙 F.烧杯
(3)若要实施配制,除上述仪器外,还缺少的仪器为________。
(4)请先通过计算____(请把计算过程写在框内),再确定量取________mL浓硫酸溶液用于稀释。
(5)配制过程简述为以下各步,其正确的操作顺序为_________________(填各步骤序号)。
A.冷却至室温 B.洗涤并移液 C.量取 D.稀释 E.摇匀装瓶 F.定容 G.移液
(6)在配制过程中,下列情况对配制结果有何影响?(填“偏高”“偏低”或“无影响”)
①容量瓶未干燥,有少量蒸馏水,则所配溶液的浓度________;
②定容时若仰视刻度线,则所配溶液的浓度________;
③量取浓硫酸时若俯视刻度线,则所配溶液的浓度________;
④摇匀后,发现液面低于刻度线,再加水至刻度线________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com