
【题目】如图为实验室某浓硫酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
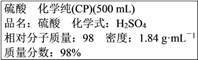
(1)通过计算可知,上述浓硫酸中H2SO4的物质的量浓度为__________molL-1。
实验室需要240 mL 2.0 mol·L-1的H2SO4溶液,现用以上浓硫酸配制,请回答下列问题:
(2)下列仪器中,不会用到的是________。
A.50 mL量筒 B.100 mL容量瓶 C.玻璃棒 D.托盘天平 E.药匙 F.烧杯
(3)若要实施配制,除上述仪器外,还缺少的仪器为________。
(4)请先通过计算____(请把计算过程写在框内),再确定量取________mL浓硫酸溶液用于稀释。
(5)配制过程简述为以下各步,其正确的操作顺序为_________________(填各步骤序号)。
A.冷却至室温 B.洗涤并移液 C.量取 D.稀释 E.摇匀装瓶 F.定容 G.移液
(6)在配制过程中,下列情况对配制结果有何影响?(填“偏高”“偏低”或“无影响”)
①容量瓶未干燥,有少量蒸馏水,则所配溶液的浓度________;
②定容时若仰视刻度线,则所配溶液的浓度________;
③量取浓硫酸时若俯视刻度线,则所配溶液的浓度________;
④摇匀后,发现液面低于刻度线,再加水至刻度线________。
【答案】 18.4 BDE 250mL容量瓶、胶头滴管 27.2mL 稀溶液有n=C稀V稀=2.0mol/L × 0.25L=0.5mol,浓溶液的体积V浓=n/C浓=0.5mol/18.4molL-1=27.2mL(保留一位小数才给分) CDAGBFE 无影响 偏低 偏低 偏低
【解析】(1)根据![]() 可知该浓硫酸的物质的量浓度为:
可知该浓硫酸的物质的量浓度为: ![]() ;(2)没有240mL容量瓶,需要配制250mL溶液,需要硫酸的物质的量为:2.0mol/L×0.25L=0.5mol,配制过程中硫酸的物质的量不变,则需要18.4mol/L的浓硫酸的体积为:0.5mol÷18.4mol/L≈0.02717L=27.2mL,因此需要50mL量筒。配制溶液的一般步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶、贴标签,需要的仪器为:量筒、烧杯、玻璃棒、250mL容量瓶和胶头滴管,所以不需要的是BDE;(3)根据以上分析可知还缺少的仪器为250mL容量瓶和胶头滴管;(4)根据以上分析可知需要浓硫酸的体积是27.2mL;(5)根据以上分析可知正确的操作顺序为CDAGBFE;(6)①容量瓶未干燥,有少量蒸馏水,不会影响;②定容时若仰视刻度线,液面在刻度线上方,则所配溶液的浓度偏低;③量取浓硫酸时若俯视刻度线,量取的浓硫酸体积减少,则所配溶液的浓度偏低;④摇匀后,发现液面低于刻度线,再加水至刻度线,溶液体积增加,浓度偏低。
;(2)没有240mL容量瓶,需要配制250mL溶液,需要硫酸的物质的量为:2.0mol/L×0.25L=0.5mol,配制过程中硫酸的物质的量不变,则需要18.4mol/L的浓硫酸的体积为:0.5mol÷18.4mol/L≈0.02717L=27.2mL,因此需要50mL量筒。配制溶液的一般步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶、贴标签,需要的仪器为:量筒、烧杯、玻璃棒、250mL容量瓶和胶头滴管,所以不需要的是BDE;(3)根据以上分析可知还缺少的仪器为250mL容量瓶和胶头滴管;(4)根据以上分析可知需要浓硫酸的体积是27.2mL;(5)根据以上分析可知正确的操作顺序为CDAGBFE;(6)①容量瓶未干燥,有少量蒸馏水,不会影响;②定容时若仰视刻度线,液面在刻度线上方,则所配溶液的浓度偏低;③量取浓硫酸时若俯视刻度线,量取的浓硫酸体积减少,则所配溶液的浓度偏低;④摇匀后,发现液面低于刻度线,再加水至刻度线,溶液体积增加,浓度偏低。


科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是
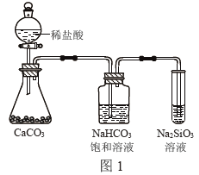
A.气态氢化物的稳定性:H2O>NH3>SiH4
B.氢元素与其他元素可形成共价化合物或离子化合物
C.图1所示实验可证明元素的非金属性:Cl>C>Si
D.用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A经图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A在常温下为非金属单质固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是_________。
②在工业生产中,大量排放的B气体被雨水吸收后形成了_________而污染环境。
(2)若A在常温下为气态化合物,C是红棕色气体。
①A、C的化学式分别是:A_________、C_________。
②写出A与O2反应的化学方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列问题:
(1)下列物质中属于电解质的是_________;属于非电解质的是_________;既不是电解质也不是非电解质的是________________。
①稀硫酸 ②盐酸 ③NaCl固体 ④硫酸钡 ⑤CCl4 ⑥铜
⑦NaHCO3 ⑧CO2 ⑨HCl ⑩氨气
(2)写出下列反应的离子方程式
①NaCl+AgNO3===AgCl↓+ NaNO3: _____________________________________;
②HCl+CH3COONa=== CH3COOH+NaCl:_____________________________________;
③Ba(OH)2与H2SO4两稀溶液混合 :_____________________________________;
(3)写出下列反应的化学方程式(写两个)CO![]() +2H+===CO2↑+H2O:
+2H+===CO2↑+H2O:
①_____________________________________;
②_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下柠檬水溶液的pH是3,其中的c(OH-)是( )
A.0.1 mol/LB.1×10-3 mol/LC.1×10-11 mol/LD.1×10-7 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)
SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
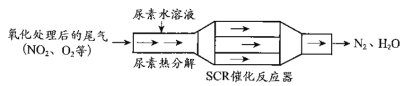
① 尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式:____________。
② 反应器中NH3还原CO2的化学方程式:____________。
③ 当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:________。
④ 尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60 mg·L1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是_________。
(2)NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示。
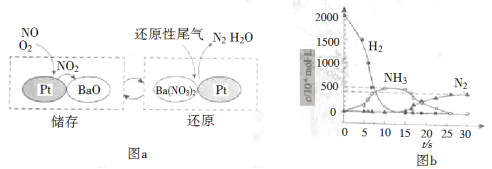
① 通过BaO和Ba(NO3)2的相互转化实验NOx的储存和还原。储存NOx的物质是_________。
② 用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是__________。
③ 还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:_______![]() □15NNO+□H2O
□15NNO+□H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:
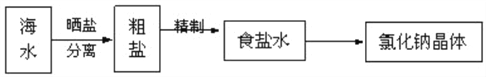
粗盐中含Ca2+、Mg2+、Fe3+、SO42﹣等杂质,提纯的步骤有:①加入过量的Na2CO3溶液;
②加入过量的BaCl2溶液; ③加入过量的NaOH溶液;④加入适量盐酸; ⑤溶解; ⑥过滤; ⑦蒸发.其正确的操作顺序是( )
A. ⑤①③②⑥④⑦ B. ⑤①②③⑥④⑦ C. ⑤②①③④⑥⑦ D. ⑤③②①⑥④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. CO2、NO2或SO2都会导致酸雨的形成 B. 木材浸过水玻璃后,具有良好的防火性能
C. 石英坩埚、水泥、陶瓷都是硅酸盐产品 D. 氯气泄漏后,人应逆风且往低处跑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com