
【题目】(14分)H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题。
Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:
H2S+Fe2(SO4)3![]() S↓+2FeSO4+H2SO4
S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是______________。
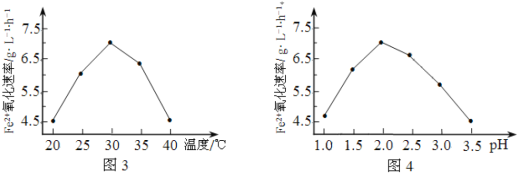
(2)由图3和图4判断使用硫杆菌的最佳条件为______________。若反应温度过高,反应速率下降,其原因是______________。
方法2:在一定条件下,用H2O2氧化H2S
(3)随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物的分子式为__________。
Ⅱ.SO2的除去
方法1(双碱法):用NaOH吸收SO2,并用CaO使NaOH再生
NaOH溶液![]() Na2SO3
Na2SO3
(4)写出过程①的离子方程式:____________________________;CaO在水中存在如下转化:
CaO(s)+H2O (l) ![]() Ca(OH)2(s)
Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq)
Ca2+(aq)+2OH(aq)
从平衡移动的角度,简述过程②NaOH再生的原理____________________________________。
方法2:用氨水除去SO2
(5)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L-1,溶液中的c(OH)=_________________mol·L1。将SO2通入该氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=___________________。
)=___________________。
【答案】(14分)
(1)降低反应活化能(或作催化剂)
(2)30 ℃、pH=2.0 蛋白质变性(或硫杆菌失去活性)
(3)H2SO4
(4)2OH-+ SO2![]() SO32-+H2O
SO32-+H2O
SO32-与Ca2+生成CaSO3沉淀,平衡向正向移动,有NaOH生成
(5)6.0×10-3 0.62
【解析】
(1)根据硫杆菌存在时的反应速率可知,硫杆菌的作用是作催化剂,降低了反应的活化能。
(2)根据图3可知,温度30℃左右时,氧化速率最大,根据图4可知,pH=2.0时氧化速率最大,所以使用硫杆菌的最佳条件为30℃、pH=2.0;若反应温度过高,硫杆菌蛋白质变性失去活性造成反应速率下降。
(3)根据化合价升降,当n(H2O2)/n(H2S)=4时,4mol H2O2转移8mol电子,则1mol H2S也转移8mol电子,化合价从-2价升高到+6价,所以氧化产物为H2SO4。
(4)过程①是NaOH与SO2的反应,反应的离子方程式为2OH-+ SO2![]() SO32-+H2O;根据CaO在水中的转化:CaO(s)+ H2O (l)
SO32-+H2O;根据CaO在水中的转化:CaO(s)+ H2O (l) ![]() Ca(OH)2(s)
Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq),过程②中Na2SO3加入CaO后,SO32-与Ca2+生成CaSO3沉淀,平衡向正向移动,有NaOH生成。
Ca2+(aq)+2OH(aq),过程②中Na2SO3加入CaO后,SO32-与Ca2+生成CaSO3沉淀,平衡向正向移动,有NaOH生成。
(5)根据NH3·H2O的Kb=1.8×105可知, =1.8×105,当氨水的浓度为2.0 mol·L-1时,溶液中的c(OH)= c(NH4+)=6.0×10-3。
根据H2SO3的Ka2=6.2×108可知, =6.2×108,,当c(OH)降至1.0×107 mol·L1,溶液中的c(SO32-)/c(HSO3-)=0.62。


科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A.Ka2(H2X)的数量级为10-6
B.曲线N表示pH与![]() 的变化关系
的变化关系
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2CO3和NaHCO3的下列说法中正确的是( )
A. 用澄清的石灰水可以鉴别Na2CO3和NaHCO3
B. NaHCO3比Na2CO3稳定,而Na2CO3比NaHCO3易溶于水
C. Na2CO3的酚酞溶液比NaHCO3的酚酞溶液颜色深
D. 等物质的量的Na2CO3和NaHCO3与足量盐酸反应,消耗盐酸的物质量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是
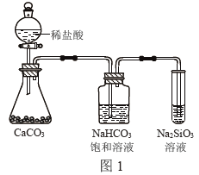
A.气态氢化物的稳定性:H2O>NH3>SiH4
B.氢元素与其他元素可形成共价化合物或离子化合物
C.图1所示实验可证明元素的非金属性:Cl>C>Si
D.用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(18分)2-氨基-3-氯苯甲酸(F)是重要的医药中间体,其制备流程图如下:
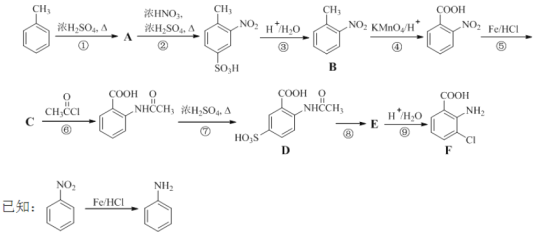
回答下列问题:
(1)![]() 分子中不同化学环境的氢原子共有_______种,共面原子数目最多为_______。
分子中不同化学环境的氢原子共有_______种,共面原子数目最多为_______。
(2)B的名称为_________。写出符合下列条件B的所有同分异构体的结构简式_______。
a.苯环上只有两个取代基且互为邻位 b.既能发生银镜反应又能发生水解反应
(3)该流程未采用甲苯直接硝化的方法制备B,而是经由①②③三步反应制取B,其目的是______________。
(4)写出⑥的化学反应方程式:_________,该步反应的主要目的是____________。
(5)写出⑧的反应试剂和条件:_______________;F中含氧官能团的名称为__________。
(6)在方框中写出以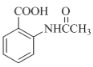 为主要原料,经最少步骤制备含肽键聚合物的流程。
为主要原料,经最少步骤制备含肽键聚合物的流程。
|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饭后,婷婷围着纯棉围裙,载着橡胶手套,洗刷不锈钢锅和陶瓷碗碟。下列说法不正确的是( )
A. 纯棉属于复合材料
B. 橡胶属于高分子材料
C. 不锈钢属于合金材料
D. 陶瓷属于硅酸盐材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础](15分)
氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:
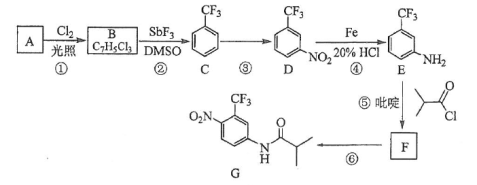
回答下列问题:
(1)A的结构简式为____________。C的化学名称是______________。
(2)③的反应试剂和反应条件分别是____________________,该反应的类型是__________。
(3)⑤的反应方程式为_______________。吡啶是一种有机碱,其作用是____________。
(4)G的分子式为______________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有______种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
)制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)
SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
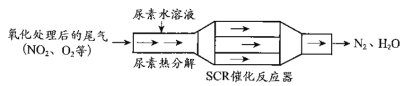
① 尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式:____________。
② 反应器中NH3还原CO2的化学方程式:____________。
③ 当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:________。
④ 尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60 mg·L1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是_________。
(2)NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示。
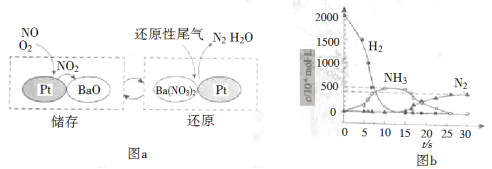
① 通过BaO和Ba(NO3)2的相互转化实验NOx的储存和还原。储存NOx的物质是_________。
② 用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是__________。
③ 还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:_______![]() □15NNO+□H2O
□15NNO+□H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com