
����Ŀ���밴Ҫ��ش��������⣺
��1�����������a��NaOH b��Ar c��MgCl2 d��HCl e��NH3 f��KNO3
�ٲ�����ѧ����������_______������ţ���ͬ����
�ڼȺ������Ӽ��ֺ��й��ۼ���������______��
��ֻ�������Ӽ���������________��
��2�����б仯�У�����Ҫ�ƻ���ѧ������______��
A���Ȼ�������ˮ B�����������ʹ��ֽ�
C�������� D���Ȼ�������ˮ
��3��ʵ����ʢ�ż�Һ���Լ�ƿ�����ò�����������������Ϊ���������ӷ���ʽ��ʾ��ԭ��_________����дһ��������ͨ��������Ҫ��Ӧ�Ļ�ѧ����___________________��
��4���������õİ뵼����ϣ�д����ҵ�������ֹ�Ļ�ѧ����ʽ��__________________________��
���𰸡�b af c C SiO2��2OH-��SiO32-��H2O SiO2��Na2CO3![]() Na2SiO3��CO2����SiO2��CaCO3
Na2SiO3��CO2����SiO2��CaCO3![]() CaSiO3��CO2�� SiO2��2C
CaSiO3��CO2�� SiO2��2C![]() Si��2CO��
Si��2CO��
��������
���ݻ�ѧ���ĸ�����������𣬸������ӷ�Ӧ����ʽ����д����������
��1����������ѧ���������ǵ�ԭ�ӷ���Ar��
��Na+��OH-֮�������Ӽ���Oԭ�Ӻ�Hԭ��֮���ǹ��ۼ������ԼȺ������Ӽ��ֺ��й��ۼ���������NaOH��
��Mg2+��Cl-֮��ֻ�������Ӽ�������ֻ�������Ӽ���������MgCl2���ʴ�Ϊ��b��af��c��
��2��A. �Ȼ�������ˮ���ƻ��˹��ۼ�����A���������⣻
B.���������ʹ��ֽ⣬�ƻ������Ӽ����ۼ�����B���������⣻
C.����������ӹ�̬ת������̬���ƻ��˷��Ӽ�����������C�������⣻
D. �Ȼ�������ˮ���ƻ������Ӽ�����D���������⣬��ѡC��
��3��ʵ����ʢ�ż�Һ���Լ�ƿ�����ò������������ڲ����е�SiO2��NaOH��Ӧ������Na2SiO3��Na2SiO3���Խ�ƿ����ƿ��ճ��һ��Ӱ��ʵ��ʹ�ã����ӷ���ʽΪ��SiO2��2OH-��SiO32-��H2O����ͨ�����Ƕ���������̼���ƺ�̼��Ƹ��µ������·�Ӧ���ɹ����ơ�����ƺ�CO2������ʽΪSiO2��Na2CO3![]() Na2SiO3��CO2����SiO2��CaCO3
Na2SiO3��CO2����SiO2��CaCO3![]() CaSiO3��CO2����
CaSiO3��CO2����
��4����ҵ�������ֹ�������C��ԭSiO2����ѧ����ʽΪSiO2��2C![]() Si��2CO����
Si��2CO����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤��������ֵ������������ȷ���ǣ�������
A. �����£�0.2molFe������ˮ������Ӧ�����ɵ�H2������ĿΪ0.3NA
B. ��ҵ�õ�ⷨ���д�ͭ����ʱ��ÿת��1mol���ӣ��������ܽ��ͭԭ������Ϊ0.5NA
C. 5NH4NO3![]() 2HNO3��4N2����9H2O��Ӧ�У�����28gN2ʱ��ת�Ƶĵ�����ĿΪ3.75NA
2HNO3��4N2����9H2O��Ӧ�У�����28gN2ʱ��ת�Ƶĵ�����ĿΪ3.75NA
D. ����ȼ�ϵ����������22.4L(��״��)����ʱ����·��ͨ���ĵ�����ĿΪ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����500��ʹ������ڵ������£�ij�̶��ݻ��������з�����Ӧ��2SO2(g)+O2(g)![]() 2SO3(g)(����Ӧ����)�������й�˵����ȷ���ǣ� ��
2SO3(g)(����Ӧ����)�������й�˵����ȷ���ǣ� ��
A. �ﵽ��ѧƽ��ʱ�����������SO3�������������ٱ仯
B. �����������£�SO2����ȫת��ΪSO3
C. �ﵽ��ѧƽ��ʱ������Ӧ���淴Ӧ����������Ҷ�Ϊ��
D. �ﵽƽ��ʱ��SO2��SO3��Ũ��һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪SO2��O2��Ӧ����2molSO3ʱ���ų�������ΪQKJ����1L���ܱ������н��з�Ӧ 2SO2(g)+O2(g)![]() 2SO3(g)��SO2��O2��SO3����ʼ���ʵ����ֱ�Ϊ0.2mol��0.1mol��0.2mol������������ȷ����
2SO3(g)��SO2��O2��SO3����ʼ���ʵ����ֱ�Ϊ0.2mol��0.1mol��0.2mol������������ȷ����
A. ��Ӧ�ﵽƽ��ʱ�ų�������Ϊ0.1QKJ
B. ijʱ�̣�SO3�����ʵ���Ϊ0.28 mol����SO2��ת����Ϊ40%
C. ijʱ�̣�SO2��O2��SO3�����ʵ����ֱ�Ϊ0.3mol��0.15mol��0.15mol
D. ijʱ�̣�SO3��Ũ�ȿ���Ϊ0.4mol-1��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ǹ�ˮ����[Cr(CH3COO)2]2��2H2O(Ħ������376g/mol)��һ���������ռ�������ɫ���壬�ױ����������������ᣬ�����Ҵ���������ˮ�����ѡ����Ʊ�װ��(��ʡ�Լ��ȼ�֧��װ��)�Ͳ�������:
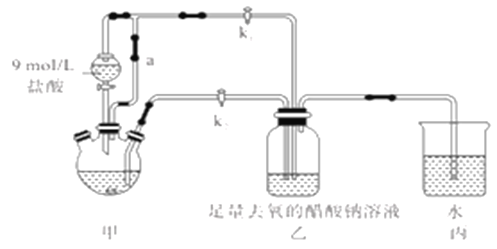
�ټ��װ��������,��������ƿ�����μ������п�ۣ�200mL0.200mol/LCrC13��Һ��
�ڹر�k2��k1,������Һ©�������������ƺõ��١�
�۴�������ƿ�ȵ���Һ������ɫ(Cr3+)��Ϊ����ɫ(Cr2+)ʱ������Һת�Ƶ�װ�����С������ִ�������ɫ����ʱ���رշ�Һ©����������
�ܽ�װ�����л������ٹ��ˡ�ϴ�Ӻ�������õ�11.28g[Cr(CH3COO)2]2��2H2O
��1��װ�ü�����ͨ��a��������________����μ����װ�õ��������Ƿ�����?__________��
��2�����ɺ���ɫ��������ӷ�Ӧ����ʽ____________________________��
��3�����������Һ�Զ�ת����װ�����е�ʵ�����Ϊ________________��
��4��װ�ñ���������________________��
��5��Ϊ�õ���������IJ�Ʒ��ϴ��ʱ��ʹ�õ��Ⱥ�˳��ѡ������ϴ�Ӽ�__________(�����)��
������ ������ˮ(�����ȴ) ����ˮ�Ҵ� ������
��6����ʵ����[Cr(CH3COO)2]2��2H2O�IJ�����______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ѧ�̲���Ԫ�����ڱ���һ���֣����б��A~R 15��Ԫ�أ��Ը������ǻش��������⣨�����Ԫ�ط�������ѧʽ����
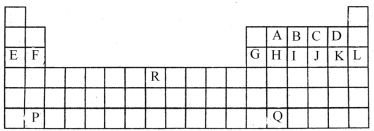
��1����ѧ��������õ���____��ԭ�Ӱ뾶��С���ǣ���ϡ������Ԫ�أ�___���ڹ���Ԫ�ص���____����A~R�е���������
��2������������Ӧ��ˮ������������ǿ����_____����������������ǿ����________����������Ԫ���γɵļ������а뾶��С����______��
��3��F��K�γɵĻ���������ˮ�������룬���ƻ��Ļ�ѧ��Ϊ______��
��4��Q��Ԫ�����ڱ��е�λ����_____��B��C���γɻ�����B2C���û�����ĺ����������Ϊ_____��
��5��P������������Ӧ��ˮ������B������������Ӧ��ˮ��������ӷ���ʽ��____________��
��6��Ԫ��E��Ԫ��F��ȣ������Խ�ǿ����________����Ԫ�ط��ű�ʾ�������б�������֤����һ��ʵ����______������ţ���
a�����ᷴӦʱ��ÿ��Fԭ�ӱ�ÿ��Eԭ��ʧ��������
b��E���⻯���F���⻯���ȶ�
c��E��F�ĵ�����ˮ��ӦE�Ͼ���
d������������Ӧˮ�������E��Fǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����������ijŨ��Fe2+ΪFe3+���̵�ʵ�����������й�˵����ȷ����
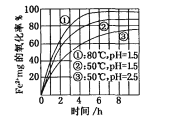
A. pH=1.5ʱ������һ����pH=2.5ʱ��
B. ����������ͬʱ��80��������ʱ�50���
C. Fe2+�������ʽ�����Һ��pH���¶��й�
D. ���������̵����ӷ���ʽΪ��Fe2++O2+4H+=Fe3++2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ��е�һ����Ԫ�أ���Ԫ�ط��Ż�ѧʽ�ش��������⣺
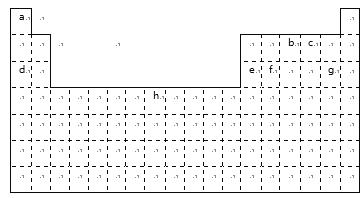
��1��hԪ�������ڱ��е�λ����_______��
��2����������Ԫ���У���������ǿ����____��Ԫ����ۺ�����������ǿ����____�����ѧʽ��
��3��c��d��e��g�У����Ӱ뾶��С����____���������ӷ��ţ�
��4��a��b����ʱ�γ�_____����a��d����ʱ�γ�______����
��5����a��c��d�γɵĻ�����ĵ���ʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ס��ҡ����� X ��4����ѧ��ѧ�г��������ʣ���ת����ϵ������ͼ�����ֲ�������ȥ��������˵���У���ȷ����
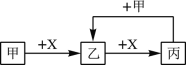
A. ����Ϊ�����������һ��ΪFeCl3
B. ����Ϊǿ���Xһ��ΪCO2
C. ������һ�ְ�ɫ��״�����������Һ��һ������Al3+
D. ����Ϊ���ʣ���˹�ϵ���漰�ķ�Ӧһ������������ԭ��Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com