
【题目】一定温度下,对可逆反应A(g)+2B(g)![]() 3C(g)的下列叙述中,能说明反应已达到平衡的是( )
3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A.单位时间内消耗amolA,同时消耗3amolC
B.容器内的总强不再变化
C.混合气体的总物质的量不再变化
D.混合气体的密度不再变化
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】电絮凝的反应原理是以铝、铁等金属为阳极,在直流电的作用下,阳极被溶蚀,产生金属离子,在经一系列水解、聚合及氧化过程,发展成为各种羟基络合物、多核羟基络合物以及氢氧化物,使废水中的胶态杂质、悬浮杂质凝聚沉淀而分离。下列说法不正确的是
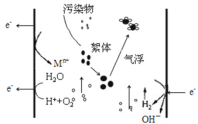
A.每产生1molO2,整个电解池中理论上转移电子数为4NA
B.阴极电极反应式为2H2O + 2e- = H2↑+2OH—
C.若铁为阳极,则阳极电极方程式为Fe-2e-=Fe2+和2H2O - 4e- = O2↑+4H+
D.若铁为阳极,则在处理废水的过程中阳极附近会发生:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用合金铝、铁、铜的废弃合金为原料制取硝酸铜晶体和氢氧化铝,并测定硝酸铜晶体的结晶水含量和氢氧化铝的纯度,设计的主要流程如下:
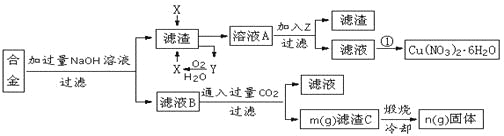
已知:
Fe2+沉淀的pH范围为7.0~9.0;Fe3+沉淀的pH范围为1.9~3.2;Cu2+沉淀的pH范围为4.7~6.7
回答下列问题:
(1)写出合金中加入NaOH溶液后所发生的离子反应方程式_______________________。试剂X的名称为______________。
(2)加入Z的作用是调节溶液的pH,pH范围应为_____;下列可作为试剂Z的是_______。
a.铜粉 b.氨水 c.氧化铜 d.硫酸铜
(3)实验操作①依次是_________、_________、过滤洗涤即可得硝酸铜晶体。
(4)测定硝酸铜晶体的结晶水含量,下列方案中肯定不可行的是______。(选填编号)
a.称量样品→加热→冷却→称量CuO
b.称量样品→加热→冷却→称量Cu(NO3)2
c.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量
d.称量样品→加过量已知量的NaOH溶液→选用酚酞指示剂用标准盐酸滴定
(5)根据流程图内数据计算:滤渣C中氢氧化铝的质量分数为______________________。(用m、n的代数式表示)
(6)按该流程的操作步骤,氢氧化铝质量分数的测定结果偏高的可能性是最大的,原因有_______________________________;____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为______
(2)B元素的![]() 价离子和C元素的
价离子和C元素的![]() 价离子的核外电子排布情况均与氩原子相同,则B元素的
价离子的核外电子排布情况均与氩原子相同,则B元素的![]() 价离子的结构示意图为______,C元素原子有______个能层,______个能级,______个非空原子轨道
价离子的结构示意图为______,C元素原子有______个能层,______个能级,______个非空原子轨道
(3)D元素的![]() 价离子的3d能级为半充满状态,D的元素符号为______,其基态原子的核外电子排布式为______
价离子的3d能级为半充满状态,D的元素符号为______,其基态原子的核外电子排布式为______
(4)E元素基态原子的M层全充满,N层只有一个电子,E的元素符号为______,其基态原子的简化电子排布式为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸工艺的催化氧化反应原理是:2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0,起始以相同的物质的量进行投料,测得SO2在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
2SO3(g)ΔH<0,起始以相同的物质的量进行投料,测得SO2在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
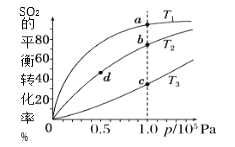
A.温度:T1>T2>T3
B.正反应速率:υ(a)>υ(c)、υ(b)>υ(d)
C.平均摩尔质量:M(a)>M(c)、M(b)>M(d)
D.平衡常数:K(a)>K(c)、K(b)>K(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是由甲苯合成乙酰水杨酸和酚酞的合成路线。

(1)写出“甲苯→A”的化学方程式____________________。
(2)写出C的结构简式___________,E分子中的含氧官能团名称为__________________;
(3)上述涉及反应中,“E→酚酞”发生的反应类型是______________。
(4)写出符合下列条件的乙酰水杨酸的一种同分异构体的结构简式_________________。
①遇FeCl3溶液显紫色, ②能与碳酸氢钠反应,
③苯环上只有2个取代基的, ④能使溴的CCl4溶液褪色。
(5)写出乙酰水杨酸和NaOH溶液完全反应的化学方程式:___________________。
(6)由D合成E有多步,请设计出D→E的合成路线_________________。(有机物均用结构简式表示)。
(合成路线常用的表示方式为:D![]() ……
……![]() E)
E)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含C、H、O三种元素的有机物M的相对分子质量小于100,经燃烧分析实验测定该有机物碳的质量分数为40%,氢的质量分数为6.7%。由此所得结论正确的是( )
A.M的分子式为CH2O
B.M的实验式为CHO
C.M不可能是2-羟基丙酸
D.M可能是饱和一元羧酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,石蕊试液在![]() 时显红色,
时显红色,![]() 时显蓝色,
时显蓝色,![]() 介于5~8之间则显紫色。请回答下列问题:
介于5~8之间则显紫色。请回答下列问题:
(1)向盛有![]() 溶液的烧杯中加入几滴石蕊试液,然后持续、缓慢地滴入
溶液的烧杯中加入几滴石蕊试液,然后持续、缓慢地滴入![]() 的盐酸,同时不断搅拌,烧杯中溶液的颜色会由蓝色依次变为浅蓝色、紫色、浅红色,最后变为______色。实验过程中,溶液中
的盐酸,同时不断搅拌,烧杯中溶液的颜色会由蓝色依次变为浅蓝色、紫色、浅红色,最后变为______色。实验过程中,溶液中![]() 的浓度逐渐__________(填“减小”“不变”或“增大”)。
的浓度逐渐__________(填“减小”“不变”或“增大”)。
(2)上述实验中 反应的离子方程式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com