
【题目】工业制硫酸工艺的催化氧化反应原理是:2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0,起始以相同的物质的量进行投料,测得SO2在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
2SO3(g)ΔH<0,起始以相同的物质的量进行投料,测得SO2在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
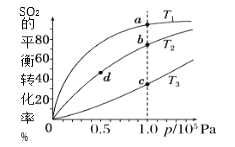
A.温度:T1>T2>T3
B.正反应速率:υ(a)>υ(c)、υ(b)>υ(d)
C.平均摩尔质量:M(a)>M(c)、M(b)>M(d)
D.平衡常数:K(a)>K(c)、K(b)>K(d)
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】某烟道气的主要成分是CO2,并含有少量硫氧化物、氮氧化物等杂质。其中的硫元素可在高温下通过CH4的作用回收,主要反应如下:2SO2(g)+CH4(g)CO2(g)+2H2O(g)+S2(g)+Q(Q>0)
(1)以mol/(Lmin)为单位,SO2的反应速率是S2生成速率的_________倍。
(2)恒容条件下,不能说明该反应已经达到平衡状态的是_______(选填编号)
a.混合气体中水蒸气含量不再变化
b.混合气体密度不发生变化
c.容器内压强不再变化
d.混合物平均相对分子质量不再变化
达到平衡后升高体系温度,则平衡常数K_________(填“增大”、“减小”、或“不变”)。
(3)请在下式中标出上述反应中电子转移的方向和数目:_____
2SO2(g)+CH4(g)…该反应的氧化产物是_________。SO2的主要性质除氧化性、漂白性外还有________性。
(4)该反应混合物中有两种极性分子,分别是______和_____;固态硫的分子式可能是S8,它与S2互为________。
(5)烟道气中的NO2也能与CH4反应并生成无害气体,完全转化3.0molNO2气体时,需要甲烷的物质的量为__________mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年11月《物理评论快报》报道了艾姆斯实验室制造的包含钙、钾、铁和砷以及少量镍的CaK(Fe1-xNix)4As4新型化合物材料,呈现出被称为刺猬自旋新磁态。有助于更好理解磁性与非常规超导性之间的联系。回答下列问题:
(1)基态镍原子的电子排布式为[Ar]______________;上述材料中所含元素的基态原子中,未成对电子数最多的是___________(填元素符号)。
(2)铁及其离子易形成配离子,如[Fe(CN)6]3-、[Fe(CN)6]4-、Fe(CO)5等。所包括的非金属元素中第一电离能最大的是__________(填元素符号);
(3)K3AsO3可用于碘的微量分析。
①K+的焰色反应呈紫色,金属元素能产生焰色实验的微观原因为____________。
②AsO33-的立体构型为________,写出一种与其互为等电子体的分子________
(填化学式)。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为___________。
(5)①金属镍的原子堆积方式如图所示,则金属镍晶胞俯视图为____。

A.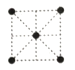 B.
B. C.
C. D.
D.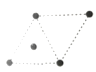
②某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为NA,该晶体的密度ρ=_____g·cm-3。
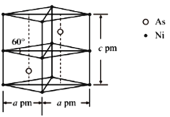
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列基态原子或离子的电子排布式(图)正确的是______(填序号,下同),违反能量最低原理的是______,违反洪特规则的是______,违反泡利原理的是______.
①![]() :
:![]()
②![]() :
:![]()
③P: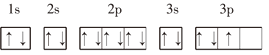
④Cr:![]()
⑤Fe:![]()
⑥![]() :
:![]()
⑦O: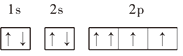
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,对可逆反应A(g)+2B(g)![]() 3C(g)的下列叙述中,能说明反应已达到平衡的是( )
3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A.单位时间内消耗amolA,同时消耗3amolC
B.容器内的总强不再变化
C.混合气体的总物质的量不再变化
D.混合气体的密度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了对锂离子电池研发作出卓越贡献的三位科学家。笔记本电脑的电池常用钴酸锂电池,其工作原理如下图所示,总反应为LixC6+Li1-xCoO2 ![]() C6+LiCoO2。下列说法不正确的是( )
C6+LiCoO2。下列说法不正确的是( )
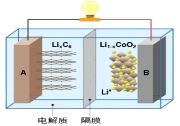
A.放电时,LixC6做负极,发生氧化反应
B.放电时,电子由负极经导线、用电器、导线到正极
C.充电时,阳极的电极反应式:LiCoO2-xe-=xLi++Li1-xCoO2
D.充电时,当导线中传递1mol电子,理论上将有1mol Li+向B极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2(g)+O2(g)→2H2O(g)+483.6kJ。下列说法或表达正确的是( )
A.在相同的条件下,2mol氢气与1mol氧气的总能量小于2mol水蒸气的总能量
B.H2(g)+![]() O2(g)→H2O(1)+Q1;Q1>241.8kJ
O2(g)→H2O(1)+Q1;Q1>241.8kJ
C.氢气燃烧是放热反应,所以氢气和氧气反应不需要其他外界条件即可发生
D.任何条件下,2L水蒸气分解成2L氢气与1L氧气需吸收483.6kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料,已知Pb的化合价只有0、+2、+4。回答下列问题:
(1)PbO2和PbO的混合物中,Pb和O的物质的量之比为8:11,则混合物中,PbO2和PbO的物质的量之比为___。
(2)用足量的CO还原13.7g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式可表示为___。
(3)PbO2具有强氧化性,能氧化浓HCl生成Cl2,+4价的Pb被还原成+2价的Pb,+2价的Pb不具备该性质,据下列信息回答问题:①将amolPbO2加热分解一段时间,生成PbO和O2;②将①所得固体加入足量的浓盐酸,收集产生的Cl2;已知在①加热一段时间后剩余的固体中,+2价的Pb占铅元素质量分数为x;则反应过程中生成的氧气和氯气物质的量总和是多少___?
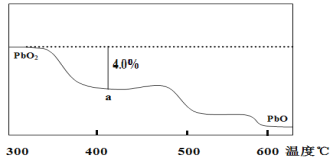
(4)PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0%((即样品起始质量—a点固体质量)/样品起始质量×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值___、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应N2+3H2![]() 2NH3+Q(Q>0),下列判断正确的是( )
2NH3+Q(Q>0),下列判断正确的是( )
A.3体积H2和足量N2反应,必定生成2体积NH3
B.工业上采用氮氢循环操作的主要目的是提高N2和H2的利用率
C.500℃左右比室温更有利于向合成氨的方向进行
D.其他条件不变,减小压强,平衡必定向右移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com