
����Ŀ��Ǧ���仯������������ء������豸��X���߷������ϣ���֪Pb�Ļ��ϼ�ֻ��0��+2��+4���ش��������⣺
��1��PbO2��PbO�Ļ�����У�Pb��O�����ʵ���֮��Ϊ8��11���������У�PbO2��PbO�����ʵ���֮��Ϊ___��
��2����������CO��ԭ13.7gijǦ����������ɵ�CO2ȫ��ͨ�뵽�����ij���ʯ��ˮ�У��õ��ij������������Ϊ8.0g�����Ǧ������Ļ�ѧʽ�ɱ�ʾΪ___��
��3��PbO2����ǿ�����ԣ�������ŨHCl����Cl2��+4�۵�Pb����ԭ��+2�۵�Pb��+2�۵�Pb���߱������ʣ���������Ϣ�ش����⣺�ٽ�amolPbO2���ȷֽ�һ��ʱ�䣬����PbO��O2���ڽ������ù������������Ũ���ᣬ�ռ�������Cl2����֪�ڢټ���һ��ʱ���ʣ��Ĺ����У�+2�۵�PbռǦԪ����������Ϊx����Ӧ���������ɵ��������������ʵ����ܺ��Ƕ���___��
��4��PbO2�ڼ��ȹ��̷����ֽ��ʧ��������ͼ��ʾ����֪ʧ�������ϵ�a��Ϊ��Ʒʧ��4.0%��������Ʒ��ʼ������a�����������/��Ʒ��ʼ������100%���IJ������塣��a�������ɱ�ʾΪPbOx��mPbO2��nPbO����ʽ����xֵ��m��nֵ___��___��
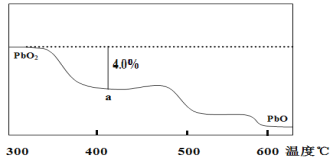
���𰸡�3��5 Pb3O4��PbO2��2PbO a(1-![]() )mol x=1.4 m��n=2��3
)mol x=1.4 m��n=2��3
��������
(1)��������PbO2��PbO�����ʵ����ֱ�Ϊxmol��ymol��Ȼ�����Ǧ���������ʵ���֮����⣻
(2)�������������8.0gΪCaCO3���������ݴ����CO2�����ʵ���������CO2�����ʵ��������Ǧ����������ԭ�ӵ����ʵ�������Ԫ�ص��������ټ����ǦԪ�ص�������Ǧԭ�ӵ����ʵ������ݴ���д��ѧʽ��
(3)����������ԭ��Ӧ�ı��ʵ��ӵ�ʧ�غ����n(O2)��n(Cl2)���������ɵ��������������ʵ����ܺ�x�ĺ�����ϵ��
(4)��a�������ɱ�ʾΪPbOx������PbO2![]() PbOx+
PbOx+![]() O2���з��̼���x��ֵ������ɱ�ʾΪmPbO2nPbO����Oԭ����Pbԭ�ӵı�ֵΪx���ݴ˼�����
O2���з��̼���x��ֵ������ɱ�ʾΪmPbO2nPbO����Oԭ����Pbԭ�ӵı�ֵΪx���ݴ˼�����
(1)��������PbO2��PbO�����ʵ����ֱ�Ϊxmol��ymol����(x+y)��(2x+y)��8��11����֮��x��y��3��5��
(2)�������������8.0gΪ̼�������������̼��Ƶ����ʵ���Ϊ![]() ���������е���ԭ�ӱ�CO��ȡ����CO2������̼Ԫ�ء���Ԫ���غ㣬��֪CO��O��CO2��CaCO3������Ǧ�������е���ԭ�ӵ����ʵ���Ϊ0.08mol����Ԫ�ص�����Ϊ0.08mol��16g/mol��1.28g������Ǧ�������е�ǦԪ�ص�����Ϊ13.7g��1.28g��12.42g��Ǧԭ�ӵ����ʵ���Ϊ
���������е���ԭ�ӱ�CO��ȡ����CO2������̼Ԫ�ء���Ԫ���غ㣬��֪CO��O��CO2��CaCO3������Ǧ�������е���ԭ�ӵ����ʵ���Ϊ0.08mol����Ԫ�ص�����Ϊ0.08mol��16g/mol��1.28g������Ǧ�������е�ǦԪ�ص�����Ϊ13.7g��1.28g��12.42g��Ǧԭ�ӵ����ʵ���Ϊ![]() ��0.06mol������Ǧ��������Ǧԭ������ԭ�ӵ����ʵ���֮��Ϊ0.06mol��0.08mol��3��4�����Ǧ������Ļ�ѧʽ�ɱ�ʾΪPb3O4��PbO2��2PbO��
��0.06mol������Ǧ��������Ǧԭ������ԭ�ӵ����ʵ���֮��Ϊ0.06mol��0.08mol��3��4�����Ǧ������Ļ�ѧʽ�ɱ�ʾΪPb3O4��PbO2��2PbO��
(3)�������⣺amolPbO2�ֽ����û������n(Pb2+)��axmol��n(Pb4+)��(1-x)amol���ڷ�Ӧ������amolPbO2��+4�۵�Pb����ǿ����������������+4�۵�Pb����ȫ������Ϊ+2�ۡ����ݵ�ʧ�����غ㣺�ȼ��ȷֽ�����O2��Pb�Ļ��ϼ۴ӣ�4���͵���2��n(Pb2+)��axmol����õ����ӵ����ʵ���Ϊ2axmol��O�Ļ��ϼ۴ӣ�2���ߵ�0������1molO2��Ҫʧȥ4mol���ӣ���n(O2)��![]() amol��
amol��![]() amol��������������Ũ���ᷴӦ����Cl2��ʣ���Pb(4��)ȫ��ת��Ϊ��2�ۣ�n(Pb4+)��(1-x)amol����õ����ӵ����ʵ���Ϊ2(1-x)amol������1molCl2����Ҫת��2mol���ӣ���n(Cl2)��
amol��������������Ũ���ᷴӦ����Cl2��ʣ���Pb(4��)ȫ��ת��Ϊ��2�ۣ�n(Pb4+)��(1-x)amol����õ����ӵ����ʵ���Ϊ2(1-x)amol������1molCl2����Ҫת��2mol���ӣ���n(Cl2)��![]() mol��(1-x)amol������n(O2)+n(Cl2)��
mol��(1-x)amol������n(O2)+n(Cl2)��![]() amol+(1-x)amol��(1-
amol+(1-x)amol��(1-![]() )amol��
)amol��
(4)��a�������ɱ�ʾΪPbOx������PbO2![]() PbOx+
PbOx+![]() O2����
O2���У�![]() ��32��239��4.0%�����x��1.4������ɱ�ʾΪmPbO2nPbO����Oԭ����Pbԭ�ӵı�ֵΪx����
��32��239��4.0%�����x��1.4������ɱ�ʾΪmPbO2nPbO����Oԭ����Pbԭ�ӵı�ֵΪx����![]() ��1.4��������m��n��2��3��
��1.4��������m��n��2��3��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����йػ�ѧ�����ʹ����ȷ���ǣ� ��
A.�ڻ�̬�����ԭ���У�p������ӵ�����һ������s������ӵ�����
B.Feԭ�ӵ���Χ�����Ų�ͼΪ![]()
C.���ĵ縺�Աȵ�����Ԫ�صĵ�һ�����ܱȵ�Ԫ�صĵ�һ�����ܴ�
D.ͭԭ�ӵ���Χ�����Ų�ʽΪ3d94s2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����Ṥ�յĴ�������Ӧԭ���ǣ�2SO2��g����O2��g��![]() 2SO3��g����H��0����ʼ����ͬ�����ʵ�������Ͷ�ϣ����SO2�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��
2SO3��g����H��0����ʼ����ͬ�����ʵ�������Ͷ�ϣ����SO2�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��
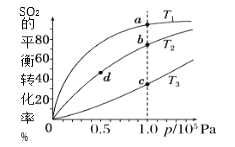
A.�¶ȣ�T1��T2��T3
B.����Ӧ���ʣ�����a��������c��������b��������d��
C.ƽ��Ħ��������M��a����M��c����M��b����M��d��
D.ƽ�ⳣ����K��a����K��c����K��b����K��d��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ��ѧϰ��ͬѧ�ǶԺ�۱�ʶ����̽�����仯������ƽ��˼���ѧ���������˽�һ������ʶ�����⡣�������ѧ֪ʶ�ش��������⣺
(1)FeCl3��Һ��________�ԣ���ᡱ�����С������ԭ����__________________�������ӷ���ʽ��ʾ��������FeCl3��Һ���ɣ����գ����õ���������� ____________��ԭ����________________________________________________��
(2)��1L 0.2 mol��L��1HA��Һ��1L 0.1 mol��L��1NaOH��Һ�������ϣ���Ϻ���Һ����仯���Բ��ƣ�����û����Һ��c��Na����>c��A������������Һ��c��HA����c��A����_____0.1 mol��L��1���>������<����������
(3)Ũ�Ⱦ�Ϊ0.1 mol/L��������Һ���Ȼ����Һ����̼�������Һ���۰�ˮ������������У�NH4+Ũ���ɴ�С��˳��Ϊ_______________________________��
(4)Ǧ�����ǵ��͵Ŀɳ���͵�أ�����ܷ�ӦʽΪ��Pb��PbO2��4H����2SO42��![]() 2PbSO4��2H2O���ŵ�ʱ�������ĵ缫��Ӧʽ��__________________________�����ʱ�������·ͨ��1 mol����ʱ�����������������������________________g��
2PbSO4��2H2O���ŵ�ʱ�������ĵ缫��Ӧʽ��__________________________�����ʱ�������·ͨ��1 mol����ʱ�����������������������________________g��
(5)��֪�������£�Ksp[Mg(OH)2]��1.8��10��11��Ksp[Fe(OH)3]��4��10��38��
�ٳ����£�ij����MgCl2��Һ�к���������FeCl3 ��Ϊ�˵õ�������MgCl2��2H2O���壬Ӧ����________���ѧʽ����������Һ��pH��4��ʹ��Һ�е�Fe3��ת��ΪFe(OH)3��������ʱ��Һ�е�c��Fe3������________mol��L��1��
�ڳ����£�����0.01 mol��L��1 MgCl2��Һ��________ mol��L��1 NaOH��Һ��������ʱ�г������ɡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��C��H��O����Ԫ�ص��л���M����Է�������С��100����ȼ�շ���ʵ��ⶨ���л���̼����������Ϊ40%�������������Ϊ6.7%���ɴ����ý�����ȷ���ǣ� ��
A.M�ķ���ʽΪCH2O
B.M��ʵ��ʽΪCHO
C.M��������2-�ǻ�����
D.M�����DZ���һԪ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�����ֵ�������й�������ȷ����
A. ��״���£�11.2L14CO2���е�������Ϊ11NA
B. 5.6gFe��������S�ۼ��ȳ�ַ�Ӧת�Ƶĵ�����Ϊ0.2NA��
C. 1molNa2O2����������������ĿΪ4NA
D. 1LpH=6�Ĵ�ˮ�к���OH������ĿΪ10-8NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��X��Y��Z��W��ԭ������������������Ԫ���γɵĵ�������Ϊm��n��p��q����ЩԪ����ɵĶ�Ԫ������r��t��u������uΪ�γ��������Ҫ����֮һ��25��ʱ��0.01mol/L��v��Һ��pH=12���������ʵ�ת����ϵ��ͼ��ʾ������˵����ȷ����

A. ԭ�Ӱ뾶�Ĵ�С:W>Z>Y>X
B. v������ˮ�ĵ����u�ܴٽ�ˮ�ĵ���
C. ճ��q���Թܿ��þƾ�ϴ��
D. Z�ֱ���Y��W��ɵĻ������л�ѧ�����Ϳ�����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������IJ����Ǻ���һ�����һ���ˮƽ�ı�־��2004���ҹ����������������λ�������һ��![]() �ǹ�ҵ���������Ҫ��Ӧ���ڴ����������£�������ܱ������г���
�ǹ�ҵ���������Ҫ��Ӧ���ڴ����������£�������ܱ������г���![]() ��
��![]() �����
�����![]() Ũ�ȣ�c����ʱ�䣨t���ı仯��ϵ��ͼ��ʾ��
Ũ�ȣ�c����ʱ�䣨t���ı仯��ϵ��ͼ��ʾ��
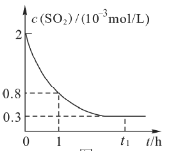
��1����0��1h��Сʱ���ڣ���![]() Ũ�ȱ仯��ʾ�÷�Ӧ��ƽ��������____________
Ũ�ȱ仯��ʾ�÷�Ӧ��ƽ��������____________
A.![]() B.
B.![]()
C.![]() D.
D.![]()
��2��Ϊ�ӿ�÷�Ӧ�����ʣ����д�ʩ���е���___________
A.�����¶�B.ʹ�ø���Ч�Ĵ���
C.��С![]() ��Ũ��D.��С
��Ũ��D.��С![]() ��Ũ�ȣ�
��Ũ�ȣ�
��3������![]() ʱ�̵ķ�Ӧ��ϵ������˵����ȷ����____________
ʱ�̵ķ�Ӧ��ϵ������˵����ȷ����____________
A.��Ӧ��ȫֹͣB.![]() ����ȫת��Ϊ
����ȫת��Ϊ![]()
C.��Ӧδ�ﵽƽ��״̬D.![]() ��Ũ�Ⱦ����ٱ仯
��Ũ�Ⱦ����ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӵĹ�ҵ��ˮ�Ĵ���������ͼ��ʾ��

��1��������ͼ�豸���н��е��Dz���________(��д��������)��ʵ��������һ������������_______(����������)���С�
�����豸�������豸��������A��______________(�ѧʽ����ͬ)�����豸�������豸��������B��___________��
�����豸���з�����Ӧ�Ļ�ѧ����ʽΪ_____________________��
�����豸���У�����B��ˮ��Һ��CaO��Ӧ������NaOH��H2O��______��ͨ�� _________________(���������)����������ʹ��������롣
��ͼ�У���ѭ��ʹ�õ�������_______��_____________C6H6��CaO��
��2��Ϊ�˷�ֹˮԴ��Ⱦ���ü����������Եķ�������ij�����ŷŵ���ˮ�����ޱ��ӣ��˷�����____________��
�ӷ�ˮ�л��ձ��ӵķ����Ǣ����л��ܼ���ȡ��Һ�еı��ӣ��ڼ���ij��ҩƷ��ˮ��Һʹ�������л��ܼ����룻�ۼ���ij�������������ӡ���д�������������ķ�Ӧ����ʽ��_________________________��
��3��Ϊ�ⶨ��ˮ�б��ӵĺ�����ȡ�˷�ˮ100 mL�������м���Ũ��ˮ�����ٲ�������Ϊֹ���õ�����0.331 g����˷�ˮ�б��ӵĺ���____________(mg��L��1)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com