
ЁОЬтФПЁПСђЫсЕФВњСПЪЧКтСПвЛИіЙњМвЛЏЙЄЫЎЦНЕФБъжОЁЃ2004ФъЮвЙњДпЛЏМССђЫсВњСПМДвбЮЛОгЪРНчЕквЛЁЃ![]() ЪЧЙЄвЕжЦСђЫсЕФживЊЗДгІЁЃдкДпЛЏМгШШЬѕМўЯТЃЌЯђКуШнУмБеШнЦїжаГфШы
ЪЧЙЄвЕжЦСђЫсЕФживЊЗДгІЁЃдкДпЛЏМгШШЬѕМўЯТЃЌЯђКуШнУмБеШнЦїжаГфШы![]() КЭ
КЭ![]() ЃЌВтЕУ
ЃЌВтЕУ![]() ХЈЖШЃЈcЃЉЫцЪБМфЃЈtЃЉЕФБфЛЏЙиЯЕШчЭМЫљЪОЁЃ
ХЈЖШЃЈcЃЉЫцЪБМфЃЈtЃЉЕФБфЛЏЙиЯЕШчЭМЫљЪОЁЃ
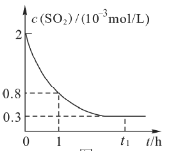
ЁО1ЁПдк0ЁЋ1hЃЈаЁЪБЃЉФкЃЌгУ![]() ХЈЖШБфЛЏБэЪОИУЗДгІЕФЦНОљЫйТЪЪЧ____________
ХЈЖШБфЛЏБэЪОИУЗДгІЕФЦНОљЫйТЪЪЧ____________
A.![]() B.
B.![]()
C.![]() D.
D.![]()
ЁО2ЁПЮЊМгПьИУЗДгІЕФЫйТЪЃЌЯТСаДыЪЉПЩааЕФЪЧ___________
A.НЕЕЭЮТЖШB.ЪЙгУИќИпаЇЕФДпЛЏМС
C.МѕаЁ![]() ЕФХЈЖШD.МѕаЁ
ЕФХЈЖШD.МѕаЁ![]() ЕФХЈЖШЃЌ
ЕФХЈЖШЃЌ
ЁО3ЁПЙигк![]() ЪБПЬЕФЗДгІЬхЯЕЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ____________
ЪБПЬЕФЗДгІЬхЯЕЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ____________
A.ЗДгІЭъШЋЭЃжЙB.![]() вбЭъШЋзЊЛЏЮЊ
вбЭъШЋзЊЛЏЮЊ![]()
C.ЗДгІЮДДяЕНЦНКтзДЬЌD.![]() ЕФХЈЖШОљВЛдйБфЛЏ
ЕФХЈЖШОљВЛдйБфЛЏ
ЁОД№АИЁП
ЁО1ЁПA
ЁО2ЁПB
ЁО3ЁПD
ЁОНтЮіЁП
ИљОнЗДгІЫйТЪБэДяЪННјааМЦЫуЃЛИљОнгАЯьЗДгІЫйТЪЕФвђЫиЗжЮіНтД№ЃЛИљОнЦНКтзДЬЌЕФНЈСЂМАЬиеїЗжЮіНтД№ЁЃ
ЁО1ЁПИљОнЭМЪОаХЯЂжЊЃК![]() ЃЌЙЪД№АИЮЊЃКAЃЛ
ЃЌЙЪД№АИЮЊЃКAЃЛ
ЁО2ЁПA. НЕЕЭЮТЖШЃЌЗДгІЫйТЪМѕТ§ЃЌЙЪAДэЮѓЃЛ
B. ЪЙгУИќИпаЇЕФДпЛЏМСЃЌЗДгІЫйТЪМгПьЃЌЙЪBе§ШЗЃЛ
C. МѕаЁ![]() ЕФХЈЖШЃЌЗДгІЮяХЈЖШНЕЕЭЃЌЗДгІЫйТЪМѕТ§ЃЌЙЪCДэЮѓЃЛ
ЕФХЈЖШЃЌЗДгІЮяХЈЖШНЕЕЭЃЌЗДгІЫйТЪМѕТ§ЃЌЙЪCДэЮѓЃЛ
D. МѕаЁ![]() ЕФХЈЖШЃЌЗДгІЮяХЈЖШНЕЕЭЃЌЗДгІЫйТЪМѕТ§ЃЌЙЪDДэЮѓЃЌЙЪД№АИЮЊЃКBЃЛ
ЕФХЈЖШЃЌЗДгІЮяХЈЖШНЕЕЭЃЌЗДгІЫйТЪМѕТ§ЃЌЙЪDДэЮѓЃЌЙЪД№АИЮЊЃКBЃЛ
ЁО3ЁПA. ![]() ЪБПЬЪБЃЌЖўбѕЛЏСђЕФХЈЖШВЛдйИФБфЃЌЫЕУїЗДгІДяЕНЦНКтзДЬЌЃЌЕЋЗДгІВЂЮДЭЃжЙЃЌЙЪAДэЮѓЃЛ
ЪБПЬЪБЃЌЖўбѕЛЏСђЕФХЈЖШВЛдйИФБфЃЌЫЕУїЗДгІДяЕНЦНКтзДЬЌЃЌЕЋЗДгІВЂЮДЭЃжЙЃЌЙЪAДэЮѓЃЛ
B. ДяЕНЦНКтЪБЃЌШЮШЛДцдкЖўбѕЛЏСђЃЌЫЕУї![]() УЛгаШЋзЊЛЏЮЊ
УЛгаШЋзЊЛЏЮЊ![]() ЃЌЙЪBДэЮѓЃЛ
ЃЌЙЪBДэЮѓЃЛ
C. ![]() ЪБПЬЪБЃЌЖўбѕЛЏСђЕФХЈЖШВЛдйИФБфЃЌЫЕУїЗДгІДяЕНЦНКтзДЬЌЃЌЙЪCДэЮѓЃЛ
ЪБПЬЪБЃЌЖўбѕЛЏСђЕФХЈЖШВЛдйИФБфЃЌЫЕУїЗДгІДяЕНЦНКтзДЬЌЃЌЙЪCДэЮѓЃЛ
D. ДяЕНЦНКтЪБЃЌ![]() ЕФХЈЖШОљВЛдйБфЛЏЃЌЙЪDе§ШЗЃЛ
ЕФХЈЖШОљВЛдйБфЛЏЃЌЙЪDе§ШЗЃЛ
ЙЪД№АИЮЊDЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЛљЬЌдзгЛђРызгЕФЕчзгХХВМЪН(ЭМ)е§ШЗЕФЪЧ______(ЬюађКХЃЌЯТЭЌ)ЃЌЮЅЗДФмСПзюЕЭдРэЕФЪЧ______ЃЌЮЅЗДКщЬиЙцдђЕФЪЧ______ЃЌЮЅЗДХнРћдРэЕФЪЧ______.
Ђй![]() ЃК
ЃК![]()
Ђк![]() ЃК
ЃК![]()
ЂлPЃК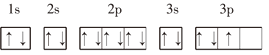
ЂмCrЃК![]()
ЂнFeЃК![]()
Ђо![]() ЃК
ЃК![]()
ЂпOЃК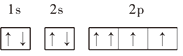
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
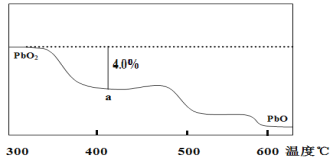
ЁОЬтФПЁПЧІМАЦфЛЏКЯЮяПЩгУгкаюЕчГиЁЂФЭЫсЩшБИМАXЩфЯпЗРЛЄВФСЯЃЌвбжЊPbЕФЛЏКЯМлжЛга0ЁЂ+2ЁЂ+4ЁЃЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉPbO2КЭPbOЕФЛьКЯЮяжаЃЌPbКЭOЕФЮяжЪЕФСПжЎБШЮЊ8ЃК11ЃЌдђЛьКЯЮяжаЃЌPbO2КЭPbOЕФЮяжЪЕФСПжЎБШЮЊ___ЁЃ
ЃЈ2ЃЉгУзуСПЕФCOЛЙд13.7gФГЧІбѕЛЏЮяЃЌАбЩњГЩЕФCO2ШЋВПЭЈШыЕНЙ§СПЕФГЮЧхЪЏЛвЫЎжаЃЌЕУЕНЕФГСЕэИЩдяКѓжЪСПЮЊ8.0gЃЌдђДЫЧІбѕЛЏЮяЕФЛЏбЇЪНПЩБэЪОЮЊ___ЁЃ
ЃЈ3ЃЉPbO2ОпгаЧПбѕЛЏадЃЌФмбѕЛЏХЈHClЩњГЩCl2ЃЌ+4МлЕФPbБЛЛЙдГЩ+2МлЕФPbЃЌ+2МлЕФPbВЛОпБИИУаджЪЃЌОнЯТСааХЯЂЛиД№ЮЪЬтЃКЂйНЋamolPbO2МгШШЗжНтвЛЖЮЪБМфЃЌЩњГЩPbOКЭO2ЃЛЂкНЋЂйЫљЕУЙЬЬхМгШызуСПЕФХЈбЮЫсЃЌЪеМЏВњЩњЕФCl2ЃЛвбжЊдкЂйМгШШвЛЖЮЪБМфКѓЪЃгрЕФЙЬЬхжаЃЌ+2МлЕФPbеМЧІдЊЫижЪСПЗжЪ§ЮЊxЃЛдђЗДгІЙ§ГЬжаЩњГЩЕФбѕЦјКЭТШЦјЮяжЪЕФСПзмКЭЪЧЖрЩй___ЃП
ЃЈ4ЃЉPbO2дкМгШШЙ§ГЬЗЂЩњЗжНтЕФЪЇжиЧњЯпШчЭМЫљЪОЃЌвбжЊЪЇжиЧњЯпЩЯЕФaЕуЮЊбљЦЗЪЇжи4.0%ЃЈЃЈМДбљЦЗЦ№ЪМжЪСПЁЊaЕуЙЬЬхжЪСПЃЉ/бљЦЗЦ№ЪМжЪСПЁС100%ЃЉЕФВаСєЙЬЬхЁЃШєaЕуЙЬЬхзщГЩБэЪОЮЊPbOxЛђmPbO2ЁЄnPbOЃЌСаЪНМЦЫуxжЕКЭmЃКnжЕ___ЁЂ___ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПБНМзЫсЪЧвЛжжживЊЕФЛЏЙЄдСЯЁЃЪЕбщЪвКЯГЩБНМзЫсЕФдРэМАзАжУЪОвтЭМ(МгШШЁЂ МаГжМАИЈжњвЧЦїЪЁТд)КЭвЛаЉЯрЙиаХЯЂШчЯТЃК
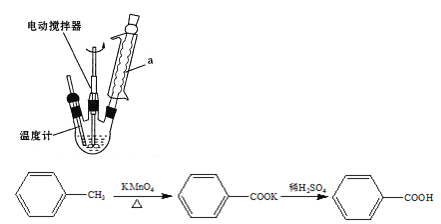
УћГЦ | адзД | ШлЕуЃЈЁцЃЉ | ЗаЕуЃЈЁцЃЉ | УмЖШЃЈg/mLЃЉ | ШмНтад | |
ЫЎ | ввДМ | |||||
МзБН | ЮоЩЋвКЬхвзШМвзЛгЗЂ | Љ95 | 110.6 | 0.8669 | ВЛШм | ЛЅШм |
БНМзЫс | АзЩЋЦЌзДЛђеызДОЇЬх | 112.4ЃЈ100ЁцзѓгвЩ§ЛЊЃЉ | 248 | 1.2659 | ЮЂШм | взШм |
БНМзЫсдкЫЎжаЕФШмНтЖШШчБэЃК
ЮТЖШ/Ёц | 4 | 18 | 75 |
ШмНтЖШ/g | 0.2 | 0.3 | 2.2 |
ФГбЇЯАаЁзщдкЪЕбщЪвжЦБИЁЂЗжРыЁЂЬсДПБНМзЫсЃЌВЂВтЖЈЫљЕУбљЦЗЕФДПЖШЃЌВНжшШчЯТЃК
Ђё.дкb жаМгШы 2.7 mL МзБНЁЂ100 mLЫЎКЭМИЦЌЫщДЩЦЌЃЌПЊЖЏЕчЖЏНСАшЦїЃЌaжаЭЈЫЎЁЃНЋb жаЕФвКЬхМгШШжСЗаЬкЃЌЗжХњМгШы 8.5 g ИпУЬЫсМиЃЌМЬајНСАшдМ5 hЃЌЭЃжЙМгШШКЭНСАшЃЌОВжУЁЃ
Ђђ.дкЗДгІЛьКЯЮяжаМгШывЛЖЈСПВнЫс(H2C2O4)ГфЗжЗДгІЃЌЙ§ТЫЁЂЯДЕгЃЌНЋТЫвКЗХдкБљЫЎдЁжаРфШДЃЌдйгУХЈбЮЫсЫсЛЏЃЌБНМзЫсШЋВПЮіГіКѓМѕбЙЙ§ТЫЃЌРфЫЎЯДЕгЃЌИЩдяЃЌЕУЕНДжВњЦЗЁЃ
Ђѓ.ГЦШЁm gВњЦЗЃЌХфГЩ 100 mLввДМШмвКЃЌвЦШЁ25.00 mLШмвКгкзЖаЮЦПЃЌЕЮМг2ЁЋ3ЕЮЗгЬЊЃЌШЛКѓгУБъзМХЈЖШKOHШмвКЕЮЖЈЁЃЧыЛиД№ЯТСаЮЪЬтЃК
(1)зАжУaЕФзїгУ___________
(2)ЗжРыЬсДПЙ§ГЬжаМгШыЕФВнЫсЪЧвЛжжЖўдЊШѕЫсЃЌЗДгІЙ§ГЬжагаЫсЪНбЮКЭЮоЩЋЦјЬхЩњГЩЁЃМгШыВнЫсЕФзїгУ_______ЃЌЧыгУРызгЗНЪНБэЪОИУЗДгІдРэ_____ЁЃ
(3)ВњЦЗМѕбЙЙ§ТЫЪБгУРфЫЎЯДЕгЕФдвђЪЧ_____________
(4)бЁгУЯТСа________(бЁЬюзжФИ)ВйзїЃЌПЩвдНЋДжВњЦЗНјвЛВНЬсДПЁЃ
A ШмгкЫЎКѓЙ§ТЫ B ШмгкввДМКѓеєСѓ
C гУМзБНнЭШЁКѓЗжвК D Щ§ЛЊ
(5)ВтЖЈДПЖШВНжшжаЃЌЕЮЖЈжеЕуШмвКЕФбеЩЋБфЛЏЪЧ__ЁЃШєmЃН1.200 gЃЌЕЮЖЈЪБгУШЅ0.1200 molЁЄLЃ1 БъзМKOHШмвК20.00 mLЃЌдђЫљЕУВњЦЗжаБНМзЫсЕФжЪСПЗжЪ§ЮЊ______ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПРћгУЗДгІ6NO2ЃЋ8NH3ЃН7N2ЃЋ12H2OЙЙГЩЕчГиЕФЗНЗЈЃЌМШФмЪЕЯжгааЇЯћГ§ЕЊбѕЛЏЮяЕФХХЗХЃЌМѕЧсЛЗОГЮлШОЃЌгжФмГфЗжРћгУЛЏбЇФмЃЌзАжУШчЭМЫљЪОЁЃ

ЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
A. ЕчСїДггвВрЕчМЋОЙ§ИКдиКѓСїЯђзѓВрЕчМЋ
B. ЮЊЪЙЕчГиГжајЗХЕчЃЌРызгНЛЛЛФЄашбЁгУвѕРызгНЛЛЛФЄ
C. ЕчМЋAМЋЗДгІЪНЮЊЃК2NH3Ѓ6eЃЃНN2ЃЋ6HЃЋ
D. ЕБга4.48LNO2(БъзМзДПі) БЛДІРэЪБЃЌзЊвЦЕчзгЮЊ0.8mol
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПSiдЊЫидкЕиПЧжаКЌСПНЯИпЃЌгУЦфЕЅжЪЛђЛЏКЯЮяЩњВњЕФМЦЫуЛњаОЦЌЁЂЙтЕМЯЫЮЌЁЂГЌгВВФСЯЁЂИЩдяМСЕШОпгаЙуЗКЕФгІгУЁЃЧыЛиД№ЯТСаЮЪЬтЃК
(1) SiдзгКЫЭтга3ИіЕчзгВуЃЌЫљвдSiЮЛгкдЊЫижмЦкБэЕФЕк____жмЦкЁЃ
(2) SiгыCЭЌЪєгкЕк![]() зхдЊЫиЃЌЕЋSiЕФдзгАыОЖБШCЕФ___ЃЈЬюЁАДѓЁБЛђЁАаЁЁБЃЉЁЃ
зхдЊЫиЃЌЕЋSiЕФдзгАыОЖБШCЕФ___ЃЈЬюЁАДѓЁБЛђЁАаЁЁБЃЉЁЃ
(3) SiCжа![]() дЊЫиЯде§МлЃЌЫљвдSiЕФЗЧН№ЪєадБШCЕФ____ЃЈЬюЁАЧПЁБЛђЁАШѕЁБЃЉЁЃ
дЊЫиЯде§МлЃЌЫљвдSiЕФЗЧН№ЪєадБШCЕФ____ЃЈЬюЁАЧПЁБЛђЁАШѕЁБЃЉЁЃ
(4) SiдЊЫизюИпМлбѕЛЏЮяЖдгІЕФЫЎЛЏЮяЪЧвЛжжЫсЃЌЦфЛЏбЇЪНЮЊ_________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖдгкЗДгІN2+3H2![]() 2NH3+QЃЈQЃО0ЃЉЃЌЯТСаХаЖЯе§ШЗЕФЪЧЃЈ ЃЉ
2NH3+QЃЈQЃО0ЃЉЃЌЯТСаХаЖЯе§ШЗЕФЪЧЃЈ ЃЉ
A.3ЬхЛ§H2КЭзуСПN2ЗДгІЃЌБиЖЈЩњГЩ2ЬхЛ§NH3
B.ЙЄвЕЩЯВЩгУЕЊЧтбЛЗВйзїЕФжївЊФПЕФЪЧЬсИпN2КЭH2ЕФРћгУТЪ
C.500ЁцзѓгвБШЪвЮТИќгаРћгкЯђКЯГЩАБЕФЗНЯђНјаа
D.ЦфЫћЬѕМўВЛБфЃЌМѕаЁбЙЧПЃЌЦНКтБиЖЈЯђгввЦЖЏ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЫцзХЕЊбѕЛЏЮяЖдЛЗОГМАШЫРрЛюЖЏгАЯьЕФШеЧїбЯжиЃЌШчКЮЯћГ§ДѓЦјЮлШОЮяжаЕФЕЊбѕЛЏЮяГЩЮЊШЫУЧЙизЂЕФжївЊЮЪЬтжЎвЛЁЃ
Ђё.РћгУNH3ЕФЛЙдадПЩвдЯћГ§ЕЊбѕЛЏЮяЕФЮлШОЃЌЦфжаГ§ШЅNOЕФжївЊЗДгІШчЯТЃК4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) ЁїHЃМ0
5N2(g)+6H2O(l) ЁїHЃМ0
(1)аДГівЛжжПЩвдЬсИпNOЕФзЊЛЏТЪЕФЗНЗЈЃК__________
(2)вЛЖЈЮТЖШЯТЃЌдкКуШнУмБеШнЦїжаАДееn(NH3)ЉUn(NO) =2ЉU3ГфШыЗДгІЮяЃЌЗЂЩњЩЯЪіЗДгІЁЃЯТСаВЛФмХаЖЯИУЗДгІДяЕНЦНКтзДЬЌЕФЪЧ___________
A.c(NH3)ЉUc(NO) =2ЉU3 B.n(NH3)ЉUn(N2) ВЛБф C.ШнЦїФкбЙЧПВЛБф D.ШнЦїФкЛьКЯЦјЬхЕФУмЖШВЛБф E.1molNЁЊHМќЖЯСбЕФЭЌЪБЃЌЩњГЩ1molOЁЊHМќ
(3)вбжЊИУЗДгІЫйТЪvе§=kе§ЁЄc4(NH3)ЁЄc6 (NO)ЃЌvФц=kФцЁЄcx(N2)ЁЄcy(H2O) (kе§ЁЂkФцЗжБ№ЪЧе§ЁЂФцЗДгІЫйТЪГЃЪ§)ЃЌИУЗДгІЕФЦНКтГЃЪ§K=kе§/kФц,дђx=_____ЃЌy=_______ЁЃ
(4)ФГбаОПаЁзщНЋ2molNH3ЁЂ3molNOКЭвЛЖЈСПЕФO2ГфШы2LУмБеШнЦїжаЃЌдкAg2OДпЛЏМСБэУцЗЂЩњЩЯЪіЗДгІЃЌNOЕФзЊЛЏТЪЫцЮТЖШБфЛЏЕФЧщПіШчЭМЫљЪОЃК

Ђйдк5minФкЃЌЮТЖШДг420KЩ§ИпЕН580KЃЌДЫЪБЖЮФкNOЕФЦНОљЗДгІЫйТЪv(NO)=_______;
ЂкдкгабѕЬѕМўЯТЃЌЮТЖШ580KжЎКѓNOЩњГЩN2ЕФзЊЛЏТЪНЕЕЭЕФдвђПЩФмЪЧ___________ЁЃ
Ђђ.гУФђЫи[(NH2)2CO]ЫЎШмвКЮќЪеЕЊбѕЛЏЮявВЪЧвЛжжПЩааЕФЗНЗЈЁЃNOКЭNO2ВЛЭЌХфБШЛьКЯЦјЭЈШыФђЫиШмвКжаЃЌзмЕЊЛЙдТЪгыХфБШЙиЯЕШчЭМЁЃ

(5)гУФђЫи[(NH2)2CO]ЫЎШмвКЮќЪеЬхЛ§БШЮЊ1ЁУ1ЕФNOКЭNO2ЛьКЯЦјЃЌПЩНЋNдЊЫизЊБфЮЊЖдЛЗОГЮоКІЕФЦјЬхЁЃаДГіИУЗДгІЕФЛЏбЇЗНГЬЪН____ЁЃ
(6)ЫцзХNOКЭNO2ХфБШЕФЬсИпЃЌзмЕЊЛЙдТЪНЕЕЭЕФжївЊдвђЪЧ________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП2019ФъХЕБДЖћЛЏбЇНБЪкгшяЎРызгЕчГиЕФЗЂУїепЃЌLiFePO4ЪЧяЎРызгЕчГиЕФе§МЋВФСЯЁЃгУКЌяЎЗЯдќЃЈжївЊН№ЪєдЊЫиЕФКЌСПЃКLi 8.50%ЁЂNi 6.55%ЁЂMg 13.24%ЃЉжЦБИLi2C2O4ЃЌВЂгУЦфжЦБИLiFePO4ВПЗжЙЄвеСїГЬШчЭМЃЈИУСїГЬПЩФмдьГЩЫЎЬхЩщЮлШОЃЉЃК
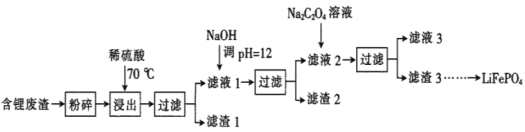
вбжЊЃКТЫвК1ЁЂТЫвК2жаВПЗжРызгЕФХЈЖШЃЈgЁЄL-1ЃЉЃК
Li+ | Ni2+ | Mg2+ | |
ТЫвК1 | 22.72 | 20.68 | 60.18 |
ТЫвК2 | 21.94 | 7.7ЁС10-3 | 0.78ЁС10-3 |
I.жЦБИLi2C2O4
(1)ТЫдќ2ЕФжївЊГЩЗжга__ЃЈЬюЛЏбЇЪНЃЉЁЃ
(2)Na2C2O4ШмвКжаИїРызгЕФХЈЖШгЩДѓЕНаЁЫГађЮЊ__ЁЃ
(3)аДГіМгШыNa2C2O4ШмвКЪБЗЂЩњЗДгІЕФРызгЗНГЬЪНЃК__ЁЃ
Ђђ.жЦБИLiFePO4
(4)НЋЕчГиМЋLi2C2O4КЭFePO4жУгкИпЮТЯТЗДгІЩњГЩLiFePO4КЭвЛжжЮТЪвЦјЬхЃЌИУЗДгІЕФЛЏбЇЗНГЬЪНЪЧ___ЁЃ
(5)LiFePO4ашвЊдкИпЮТЯТГЩаЭКѓВХФмзїЮЊЕчМЋЃЌИпЮТГЩаЭЪБвЊМгШыЩйСПЪЏФЋЃЌдђЪЏФЋЕФзїгУЪЧ__ЃЈШЮаДвЛЕуЃЉЁЃ
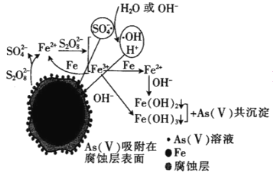
(6)ЮвЙњПЦбЇМвбаОПСуМлЬњЛюЛЏЙ§СђЫсФЦЃЈNa2S2O8ЃЉШЅГ§ЗЯЫЎжаЕФAs(Ђѕ)ЃЌЦфЛњжЦФЃаЭШчЭМЃЌЦфжаСуМлЬњгыЙ§СђЫсФЦЗДгІЕФРызгЗНГЬЪНЪЧ__ЁЃдкИУФЃаЭжаЕУЕНЕФЬњЩщЙВГСЕэЮяОзЦЩеЃЈЮодЊЫиЛЏКЯМлБфЛЏЃЉКѓЕУЕНвЛжжДХадЛЏКЯЮяЃЌЛЏбЇЪНЮЊFe7As2O14ЃЌИУЮяжЪжаЖўМлЬњгыШ§МлЬњЕФИіЪ§БШЮЊ__ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com