
【题目】2018年11月《物理评论快报》报道了艾姆斯实验室制造的包含钙、钾、铁和砷以及少量镍的CaK(Fe1-xNix)4As4新型化合物材料,呈现出被称为刺猬自旋新磁态。有助于更好理解磁性与非常规超导性之间的联系。回答下列问题:
(1)基态镍原子的电子排布式为[Ar]______________;上述材料中所含元素的基态原子中,未成对电子数最多的是___________(填元素符号)。
(2)铁及其离子易形成配离子,如[Fe(CN)6]3-、[Fe(CN)6]4-、Fe(CO)5等。所包括的非金属元素中第一电离能最大的是__________(填元素符号);
(3)K3AsO3可用于碘的微量分析。
①K+的焰色反应呈紫色,金属元素能产生焰色实验的微观原因为____________。
②AsO33-的立体构型为________,写出一种与其互为等电子体的分子________
(填化学式)。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为___________。
(5)①金属镍的原子堆积方式如图所示,则金属镍晶胞俯视图为____。

A.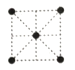 B.
B. C.
C. D.
D.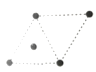
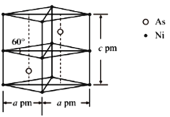
②某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为NA,该晶体的密度ρ=_____g·cm-3。
【答案】3d84s2 Fe N 电子从较高能级的激发态跃迁到较低能级的激发态乃至基态时,会以光的形式释放能量 三角锥形 PCl3、PBr3、NF3、NCl3等(答一种即可) Ni的原子半径较小,价层电子数目较多,金属键较强 C ![]()
【解析】
(1)镍是28号元素,根据构造原理写出电子排布式,根据钙、钾、铁和砷以及镍的核外电子排布式,找出未成对电子数最多的;
(2)非金属元素C、N、O、根据它们在周期表的位置,N的核外电子排布中,2p轨道为半充满,N的第一电离能高于同周期相邻的元素,判断第一电离能的大小;
(3).①电子从较高能级的激发态跃迁到较低能级的激发态乃至基态时,会以光的形式释放能量;
②AsO33-中As原子孤电子对数=![]() =1,价层电子对数=1+3=4,在VSEPR模型基础上忽略孤对电子可得微粒空间构型;互为等电子体的微粒的原子总数相等、价电子总数也相等;
=1,价层电子对数=1+3=4,在VSEPR模型基础上忽略孤对电子可得微粒空间构型;互为等电子体的微粒的原子总数相等、价电子总数也相等;
(4).金属晶体熔沸点的高低与金属键的强弱有关,金属键的强弱与价层电子数目和金属原子的半径有关;
(5) ①镍的原子堆积方式为面心立方最密堆积;②由晶胞结构可知,每个晶胞中含有2个Ni原子和2个As原子,计算晶胞的质量,晶体密度=晶胞质量÷晶胞体积。
(1)镍是28号元素,根据构造原理写出简化的电子排布式[Ar] 3d84s2,
钙、钾、铁和砷以及镍的核外电子排布式:[Ar]4s2、[Ar]4s1、[Ar]3d64s2、[Ar]3d104s24p3、[Ar]3d84s2,未成对电子数分别为0、1、4、3、2,基态原子中,未成对电子数最多的是铁,
故答案为:[Ar] 3d84s2;Fe;
(2)同周期从左到右,第一电离能呈现增大的趋势,由于氮原子的2p能级为半充满,较稳定,故C、N、O的第一电离能大小顺序为C<O<N,第一电离能较大的元素为N,
故答案为:N;
(3)①金属元素产生焰色反应的微观原因为:电子从较高能级的激发态跃迁到较低能级的激发态乃至基态 时,会以光的形式释放能量,产生焰色反应,
故答案为:电子从较高能级的激发态跃迁到较低能级的激发态乃至基态时,会以光的形式释放能量;
②AsO33中As原子孤电子对数=![]() =1,价层电子对数=1+3=4,在VSEPR模型基础上忽略孤对电子可得微粒空间构型为三角锥形;根据价电子总数和原子总数(氢等轻原子不计在内)相同的分子、离子或基团互为等电子体可知,用Cl原子替代O原子、1个单位负电荷可得与AsO33互 为等电子体的分子有PCl3等,进一步替换可得PBr3、NF3、NCl3等,
=1,价层电子对数=1+3=4,在VSEPR模型基础上忽略孤对电子可得微粒空间构型为三角锥形;根据价电子总数和原子总数(氢等轻原子不计在内)相同的分子、离子或基团互为等电子体可知,用Cl原子替代O原子、1个单位负电荷可得与AsO33互 为等电子体的分子有PCl3等,进一步替换可得PBr3、NF3、NCl3等,
故答案为:三角锥形;PCl3、PBr3、NF3、NCl3等;
(4)Ca、Ni都属于金属晶体,Ni的原子半径较小,价层电子数目较多,金属键较强,故金属Ni的熔点和沸点均比金属Ca的高,
故答案为:Ni的原子半径较小,价层电子数目较多,金属键较强;
(5) ①镍的原子堆积方式为面心立方最密堆积,故金属镍晶胞俯视图为C,
答案为C;
②由晶胞结构可知,每个晶胞中含有Ni原子数目=8×![]() +4×
+4×![]() =2,含有2个As原子,晶胞的质量=2×
=2,含有2个As原子,晶胞的质量=2×![]() g,晶胞的体积V=a×10-10cm×a×10-10cm×
g,晶胞的体积V=a×10-10cm×a×10-10cm×![]() ×c×10-10cm=
×c×10-10cm=![]() ×10-30cm3,故晶胞的密度ρ=
×10-30cm3,故晶胞的密度ρ=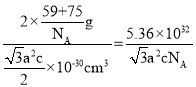 g·cm-3,
g·cm-3,
故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】某烯烃的结构简式为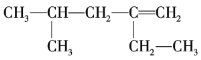 ,甲、乙、丙、丁四位同学分别将其命名为2-甲基-4-乙基-4-戊烯、2-异丁基-1-丁烯、2,4-二甲基-3-己烯、4-甲基-2-乙基-1-戊烯。下列对四位同学的命名判断正确的是( )
,甲、乙、丙、丁四位同学分别将其命名为2-甲基-4-乙基-4-戊烯、2-异丁基-1-丁烯、2,4-二甲基-3-己烯、4-甲基-2-乙基-1-戊烯。下列对四位同学的命名判断正确的是( )
A.甲的命名中对主链的选择是错误的B.乙的命名中对主链碳原子的编号是错误的
C.丙的命名中对主链的选择是正确的D.丁的命名是正确的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列有机化合物的说法正确的是( )
A.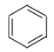 、
、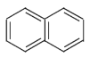 、
、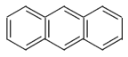 互为同系物
互为同系物
B.有机化合物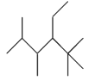 的名称是2,3,5,5-四甲基-4-乙基己烷
的名称是2,3,5,5-四甲基-4-乙基己烷
C.有机化合物![]() 中最多有16个原子共面
中最多有16个原子共面
D.有机化合物![]() 的分子式为
的分子式为![]() ,且能与
,且能与![]() 溶液反应产生
溶液反应产生![]() ,其同分异构体有8种
,其同分异构体有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的使用正确的是( )
A.在基态多电子原子中,p轨道电子的能量一定高于s轨道电子的能量
B.Fe原子的外围电子排布图为![]()
C.氧的电负性比氮大,故氧元素的第一电离能比氮元素的第一电离能大
D.铜原子的外围电子排布式为3d94s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电絮凝的反应原理是以铝、铁等金属为阳极,在直流电的作用下,阳极被溶蚀,产生金属离子,在经一系列水解、聚合及氧化过程,发展成为各种羟基络合物、多核羟基络合物以及氢氧化物,使废水中的胶态杂质、悬浮杂质凝聚沉淀而分离。下列说法不正确的是
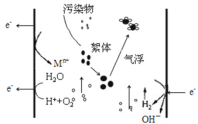
A.每产生1molO2,整个电解池中理论上转移电子数为4NA
B.阴极电极反应式为2H2O + 2e- = H2↑+2OH—
C.若铁为阳极,则阳极电极方程式为Fe-2e-=Fe2+和2H2O - 4e- = O2↑+4H+
D.若铁为阳极,则在处理废水的过程中阳极附近会发生:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.原子核外电子排布式为![]() 的原子与原子核外电子排布式为
的原子与原子核外电子排布式为![]() 的原子对应元素的化学性质相似
的原子对应元素的化学性质相似
B.![]() 的最外层电子排布式为
的最外层电子排布式为![]()
C.基态铜原子外围电子排布图为![]()
D.基态碳原子最外层电子排布图为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用合金铝、铁、铜的废弃合金为原料制取硝酸铜晶体和氢氧化铝,并测定硝酸铜晶体的结晶水含量和氢氧化铝的纯度,设计的主要流程如下:
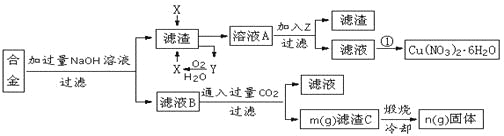
已知:
Fe2+沉淀的pH范围为7.0~9.0;Fe3+沉淀的pH范围为1.9~3.2;Cu2+沉淀的pH范围为4.7~6.7
回答下列问题:
(1)写出合金中加入NaOH溶液后所发生的离子反应方程式_______________________。试剂X的名称为______________。
(2)加入Z的作用是调节溶液的pH,pH范围应为_____;下列可作为试剂Z的是_______。
a.铜粉 b.氨水 c.氧化铜 d.硫酸铜
(3)实验操作①依次是_________、_________、过滤洗涤即可得硝酸铜晶体。
(4)测定硝酸铜晶体的结晶水含量,下列方案中肯定不可行的是______。(选填编号)
a.称量样品→加热→冷却→称量CuO
b.称量样品→加热→冷却→称量Cu(NO3)2
c.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量
d.称量样品→加过量已知量的NaOH溶液→选用酚酞指示剂用标准盐酸滴定
(5)根据流程图内数据计算:滤渣C中氢氧化铝的质量分数为______________________。(用m、n的代数式表示)
(6)按该流程的操作步骤,氢氧化铝质量分数的测定结果偏高的可能性是最大的,原因有_______________________________;____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸工艺的催化氧化反应原理是:2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0,起始以相同的物质的量进行投料,测得SO2在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
2SO3(g)ΔH<0,起始以相同的物质的量进行投料,测得SO2在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
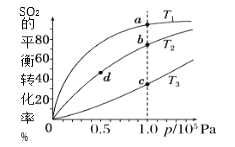
A.温度:T1>T2>T3
B.正反应速率:υ(a)>υ(c)、υ(b)>υ(d)
C.平均摩尔质量:M(a)>M(c)、M(b)>M(d)
D.平衡常数:K(a)>K(c)、K(b)>K(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。四种元素形成的单质依次为m、n、p、q;这些元素组成的二元化合物r、t、u,其中u为形成酸雨的主要物质之一;25℃时,0.01mol/L的v溶液中pH=12。上述物质的转化关系如图所示。下列说法正确的是

A. 原子半径的大小:W>Z>Y>X
B. v能抑制水的电离而u能促进水的电离
C. 粘有q的试管可用酒精洗涤
D. Z分别与Y、W组成的化合物中化学健类型可能相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com