
【题目】2019年诺贝尔化学奖颁给了对锂离子电池研发作出卓越贡献的三位科学家。笔记本电脑的电池常用钴酸锂电池,其工作原理如下图所示,总反应为LixC6+Li1-xCoO2 ![]() C6+LiCoO2。下列说法不正确的是( )
C6+LiCoO2。下列说法不正确的是( )
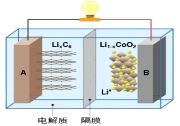
A.放电时,LixC6做负极,发生氧化反应
B.放电时,电子由负极经导线、用电器、导线到正极
C.充电时,阳极的电极反应式:LiCoO2-xe-=xLi++Li1-xCoO2
D.充电时,当导线中传递1mol电子,理论上将有1mol Li+向B极移动
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.原子核外电子排布式为![]() 的原子与原子核外电子排布式为
的原子与原子核外电子排布式为![]() 的原子对应元素的化学性质相似
的原子对应元素的化学性质相似
B.![]() 的最外层电子排布式为
的最外层电子排布式为![]()
C.基态铜原子外围电子排布图为![]()
D.基态碳原子最外层电子排布图为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫化合物在生产、生活中有广泛应用,其吸收和处理也十分重要。回答下列问题:
1.SO2具有还原性,写出将SO2气体通入 FeCl3溶液中的离子方程式_________,并标出电子转移的数目及方向。_____________________________________________________________
2.在Na2SO3溶液中滴加酚酞,溶液变红色,若在该溶液中滴入过量的BaCl2溶液,现象是_________,请结合离子方程式,运用平衡原理进行解释_____________________。
3.等体积等物质的量浓度的 NaClO溶液与Na2SO3溶液混合后,溶液显______性。此时溶液中浓度相等的微粒是___________________________________________。
4.已知:H2S:Ki1=1.3×10-7Ki2=7.1×10-15 H2CO3:Ki1=4.3×10-7Ki2=5.6×10-11
含H2S尾气用足量的Na2CO3溶液来吸收。写出离子反应方程式。____________
常温时,等体积等浓度的Na2S和Na2CO3溶液的离子总数:N前___N后(填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸工艺的催化氧化反应原理是:2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0,起始以相同的物质的量进行投料,测得SO2在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
2SO3(g)ΔH<0,起始以相同的物质的量进行投料,测得SO2在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
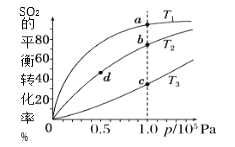
A.温度:T1>T2>T3
B.正反应速率:υ(a)>υ(c)、υ(b)>υ(d)
C.平均摩尔质量:M(a)>M(c)、M(b)>M(d)
D.平衡常数:K(a)>K(c)、K(b)>K(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源问题是现代社会发展的三大基本问题之一。
(1)焦炭可用于制取水煤气。实验测得1.2 g 碳与水蒸气完全反应生成水煤气时,吸收了13.16 kJ热量。该反应的热化学方程式为_________________________;该反应在________条件下能自发进行(选“高温”、“低温”或“任意温度”)。
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
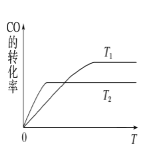
①T1________T2(填“>”、“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1________(填“>”、“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是________(填字母)。
a.降低温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。则图中t2时采取的措施可能是___________________;
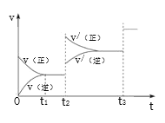
t3时采取的措施可能是 _________________。
④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP=________(MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。负极加入的物质是________;正极的电极反应为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过学习,同学们对宏观辨识与微观探析,变化观念与平衡思想等学科素养有了进一步的认识和理解。请根据所学知识回答下列问题:
(1)FeCl3溶液呈________性(填“酸”、“中”或“碱”),原因是__________________(用离子方程式表示);若把FeCl3溶液蒸干,灼烧,最后得到固体产物是 ____________,原因是________________________________________________。
(2)将1L 0.2 mol·L-1HA溶液与1L 0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中c(Na+)>c(A-),则混合溶液中c(HA)+c(A-)_____0.1 mol·L-1(填“>”、“<”或“=”)。
(3)浓度均为0.1 mol/L的四种溶液①氯化铵溶液、②碳酸氢铵溶液、③氨水、④硫酸氢铵中,NH4+浓度由大到小的顺序为_______________________________。
(4)铅蓄电池是典型的可充电型电池,电池总反应式为:Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O。放电时,负极的电极反应式是__________________________;充电时,当外电路通过1 mol电子时,理论上正极板的质量减少________________g。
2PbSO4+2H2O。放电时,负极的电极反应式是__________________________;充电时,当外电路通过1 mol电子时,理论上正极板的质量减少________________g。
(5)已知:常温下,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4×10-38。
①常温下,某酸性MgCl2溶液中含有少量的FeCl3 ,为了得到纯净的MgCl2·2H2O晶体,应加入________(填化学式),调节溶液的pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________mol·L-1。
②常温下,若将0.01 mol·L-1 MgCl2溶液与________ mol·L-1 NaOH溶液等体积混合时有沉淀生成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 标准状况下,11.2L14CO2含有的中子数为11NA
B. 5.6gFe粉与足量S粉加热充分反应转移的电子数为0.2NA,
C. 1molNa2O2固体中所含离子数目为4NA
D. 1LpH=6的纯水中含有OHˉ的数目为10-8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A是基本有机化工原料,由A合成高分子化合物C和![]() 的合成路线如图(部分反应条件略去):
的合成路线如图(部分反应条件略去):

已知:①R-Cl![]() R-CN
R-CN
②R-CN![]() R-COOH
R-COOH
③![]()
回答下列问题:
(1)A的化学名称是__。
(2)C分子中所含官能团的名称是__;G→H的反应类型是__。
(3)F→G的化学方程式是__。
(4)B的同分异构体中,某种同分异构体M与H2加成的是产物(C5H10O2),其中含有酯基并且核磁共振氢谱有4组峰,且峰面积比为6∶2∶1∶1,则M的结构简式可能是__、___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com