
【题目】含硫化合物在生产、生活中有广泛应用,其吸收和处理也十分重要。回答下列问题:
1.SO2具有还原性,写出将SO2气体通入 FeCl3溶液中的离子方程式_________,并标出电子转移的数目及方向。_____________________________________________________________
2.在Na2SO3溶液中滴加酚酞,溶液变红色,若在该溶液中滴入过量的BaCl2溶液,现象是_________,请结合离子方程式,运用平衡原理进行解释_____________________。
3.等体积等物质的量浓度的 NaClO溶液与Na2SO3溶液混合后,溶液显______性。此时溶液中浓度相等的微粒是___________________________________________。
4.已知:H2S:Ki1=1.3×10-7Ki2=7.1×10-15 H2CO3:Ki1=4.3×10-7Ki2=5.6×10-11
含H2S尾气用足量的Na2CO3溶液来吸收。写出离子反应方程式。____________
常温时,等体积等浓度的Na2S和Na2CO3溶液的离子总数:N前___N后(填“>”或“<”)。
【答案】2Fe3++SO2+2H2O=2Fe2++4H++SO42- ![]() 有白色沉淀生成,溶液红色褪去 亚硫酸钠溶液水解成碱性,滴入酚酞成红色。SO32- + H2O
有白色沉淀生成,溶液红色褪去 亚硫酸钠溶液水解成碱性,滴入酚酞成红色。SO32- + H2O![]() HSO3-+ OH-,加入氯化钡后,Ba2++SO32-→BaSO3↓,降低了SO32-的浓度,使得水解平衡往左移动,导致溶液中OH-浓度降低,因此溶液红色褪去 中 H+与OH-、SO42-与Cl- H2S + CO32-→HS-+ HCO3- >
HSO3-+ OH-,加入氯化钡后,Ba2++SO32-→BaSO3↓,降低了SO32-的浓度,使得水解平衡往左移动,导致溶液中OH-浓度降低,因此溶液红色褪去 中 H+与OH-、SO42-与Cl- H2S + CO32-→HS-+ HCO3- >
【解析】
1.SO2具有还原性,能被氯化铁氧化为单质S,反应的离子方程式为2Fe3++SO2+2H2O→2Fe2++4H++SO42-,其中电子转移的数目及方向可表示为![]() ;
;
2.在Na2SO3溶液中滴加酚酞,溶液变红色,说明亚硫酸根水解,溶液显碱性。若在该溶液中滴入过量的BaCl2溶液,则生成亚硫酸钡沉淀,抑制亚硫酸根的水解,溶液碱性降低,所以实验现象是有白色沉淀生成,溶液红色褪去;
3.等体积等物质的量浓度的 NaClO溶液与Na2SO3溶液混合后,二者恰好发生氧化还原反应生成硫酸钠和氯化钠,因此溶液显中性,此时根据电荷守恒可知溶液中浓度相等的微粒是H+与OH-、SO42-与Cl-;
4.已知:H2S:Ki1=1.3×10-7Ki2=7.1×10-15 H2CO3:Ki1=4.3×10-7Ki2=5.6×10-11,这说明酸性是H2CO3>H2S>HCO3—>HS—,则根据较强酸制备较弱酸可知含H2S尾气用足量的Na2CO3溶液来吸收反应的离子反应方程式为H2S + CO32-→HS-+ HCO3-。常温时,等体积等浓度的Na2S和Na2CO3溶液中碳酸根的水解程度小于硫离子的水解程度,即碱性是碳酸钠弱于硫化钠。根据电荷守恒可知在碳酸钠溶液中有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),在硫化钠溶液中有c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),等浓度的两溶液中,c(Na+)相同,所以溶液中的离子总数N前>N后。


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】判断下列各物质所属的类别,并把相应的序号填入表中。
①![]() ②
②![]() ③
③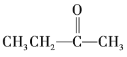 ④
④ ⑤
⑤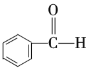 ⑥
⑥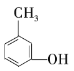 ⑦
⑦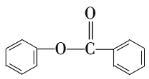 ⑧
⑧![]() ⑨
⑨![]() ⑩
⑩![]()
![]()
![]()
分类 | 芳香烃 | 卤代烃 | 醇 | 酚 | 醛 | 酮 | 羧酸 | 酯 |
物质 | ________ | _________ | ________ | _________ | _________ | ________ | p>________ | ________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学工作者研发了一种![]() 的系统,借助锂循环可持续合成氨,其原理如图所示。下列说法不正确的是( )
的系统,借助锂循环可持续合成氨,其原理如图所示。下列说法不正确的是( )
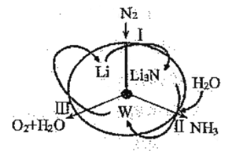
A.过程Ⅰ得到的![]() 的电子式为
的电子式为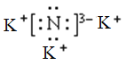
B.过程Ⅱ生成W的反应为![]()
C.反应Ⅲ中能量转化的方式是电能转变为化学能
D.过程Ⅰ、Ⅱ、Ⅲ均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂,实验室可用“溢流法”连续制备。SnCl4易挥发,极易发生水解,Cl2极易溶于SnCl4。制备原理与实验装置如图所示:
Sn(s)+2Cl2(g)=SnCl4(l) ΔH=–511kJmol-1

可能用到的有关数据如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
制备过程中,锡粒逐渐被消耗,须提拉橡胶塞及时向反应器中补加锡粒。当SnCl4液面升至侧口高度时,液态产物经侧管流入接收瓶。回答下列问题:
(1)Sn在周期表中的位置为_______________
(2)a管的作用是_______________,A中反应的离子方程式是______________。
(3)装置D的作用是________________,装置E中冷却水的作用是___________。
(4)加热Sn粒之前要先让氯气充满整套装置,其目的是___________________。
(5)锡粒中含铜杂质致E中产生CuCl2,但不影响F中产品的纯度,原因是________。实验所得SnCl4因溶解了Cl2而略显黄色,提纯SnCl4的方法是____(填序号)。
a.用NaOH溶液洗涤再蒸馏 b.升华 c.蒸馏 d.过滤
(6)尾气处理时,可选用的装置是________(填序号)。

(7)SnCl4在空气中与水蒸气反应除生成白色SnO2·xH2O固体,还可以看到大量白雾,化学方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列基态原子或离子的电子排布式(图)正确的是______(填序号,下同),违反能量最低原理的是______,违反洪特规则的是______,违反泡利原理的是______.
①![]() :
:![]()
②![]() :
:![]()
③P: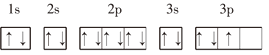
④Cr:![]()
⑤Fe:![]()
⑥![]() :
:![]()
⑦O: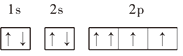
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用氨气与空气混合,通过“氨的催化氧化”等反应工业合成硝酸及其他产品。
1.将NH3与O2在一定条件下充分反应后全部转化为硝酸溶液,则此硝酸溶液中溶质的质量分数为_________________,若所得硝酸密度为ρg/cm3,则其物质的量浓度为_______(保留两位小数)。
2.某化肥厂以氨为原料制备 NH4NO3,已知由氨制 NO 的产率是 96%,NO 制硝酸的产率是 92%,氨被硝酸的吸收率为100%,则制备80吨 NH4NO3所需氨的体积(标准状况)为________m3(保留两位小数)。
3.一定量的浓硝酸与铜反应生成NO、NO2、N2O4混合气体。测出混合气体密度是同温同压下氢气的28倍。再将气体通过足量水充分吸收后,体积变为原来的2/3(相同条件下测定)。计算混合气体中NO2的体积分数_____________。
4.合成氨原料气由CH4在高温下与水蒸气、空气反应而得。反应原理如下:
CH4+2H2O→CO2+4H22CH4+O2+2H2O→2CO2+6H2
将反应后的混合气中CO2、H2O (g)通过吸收和干燥除去后,只含N2和H2。为使进入合成氨反应塔两者体积比为1∶3。计算起始气体中CH4和空气的比例。(已知空气中O2和N2的体积比为1∶4)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了对锂离子电池研发作出卓越贡献的三位科学家。笔记本电脑的电池常用钴酸锂电池,其工作原理如下图所示,总反应为LixC6+Li1-xCoO2 ![]() C6+LiCoO2。下列说法不正确的是( )
C6+LiCoO2。下列说法不正确的是( )
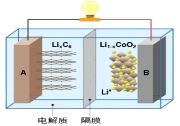
A.放电时,LixC6做负极,发生氧化反应
B.放电时,电子由负极经导线、用电器、导线到正极
C.充电时,阳极的电极反应式:LiCoO2-xe-=xLi++Li1-xCoO2
D.充电时,当导线中传递1mol电子,理论上将有1mol Li+向B极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子核外电子排布式为___。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是___ (填序号)。
a.Cl2、Br2、I2的熔点 b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d.HCl、HBr、HI的酸性
(3)工业上,通过如图转化可制得KClO3晶体:
NaCl溶液![]() NaClO3溶液
NaClO3溶液![]() KClO3晶体
KClO3晶体
II中转化的基本反应类型是___,该反应过程能析出KClO3晶体而无其它晶体析出的原因是___。
(4)晶体硅(熔点1410℃)是良好的半导体材料;四氯化硅熔点-70℃,沸点57.6℃;由粗硅制纯硅过程如图:
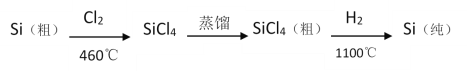
写出SiCl4的电子式:___;在上述由SiCl4制纯硅的反应中,测得生成7kg纯硅需吸收akJ热量,写出该反应的热化学方程式:___。
(5)ClO2是常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并用单线桥标出电子转移的方向和数目___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Si元素在地壳中含量较高,用其单质或化合物生产的计算机芯片、光导纤维、超硬材料、干燥剂等具有广泛的应用。请回答下列问题:
(1) Si原子核外有3个电子层,所以Si位于元素周期表的第____周期。
(2) Si与C同属于第![]() 族元素,但Si的原子半径比C的___(填“大”或“小”)。
族元素,但Si的原子半径比C的___(填“大”或“小”)。
(3) SiC中![]() 元素显正价,所以Si的非金属性比C的____(填“强”或“弱”)。
元素显正价,所以Si的非金属性比C的____(填“强”或“弱”)。
(4) Si元素最高价氧化物对应的水化物是一种酸,其化学式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com